

| 实验序号 | 实验操作 | 现 象 | 结 论 |
| Ⅰ | 将氯水滴入品红溶液 | 溶液褪色 | 氯气与水反应的产物有漂白性 |
| Ⅱ | 氯水中加入 NaHCO3粉末 | 有无色气泡产生 | 氯气与水反应的产物具有较强的酸性 |
| 实验序号 | 结论 | 理由 |
| Ⅰ | | |
| Ⅱ | | |
 Mn2++Cl2↑+2H2O(2分)
Mn2++Cl2↑+2H2O(2分) Mn2++Cl2↑+2H2O。
Mn2++Cl2↑+2H2O。

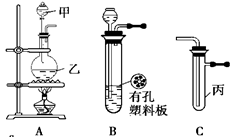
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
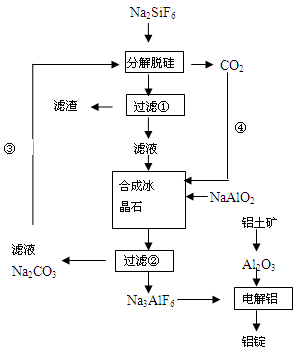
科目:高中化学 来源:不详 题型:填空题

| 滴定次数 | 样品的质量/g | KMnO4溶液的体积/mL | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 0.3000 | 1.02 | 24.04 |
| 2 | 0.3000 | 2.00 | 25.03 |
| 3 | 0.3000 | 0.20 | 23.24 |
查看答案和解析>>
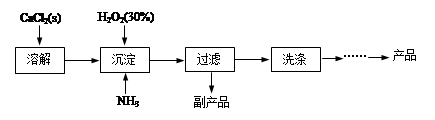
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
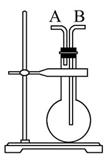
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
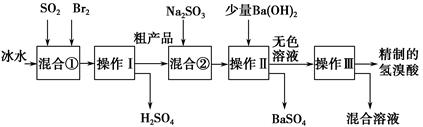
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

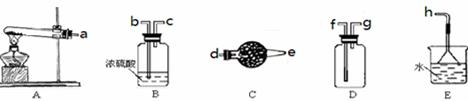
| A.Ⅰ图中:即使MnO2过量,盐酸也不能全部消耗 |
| B.Ⅱ图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成 |
| C.Ⅲ图中:生成棕色的烟 |
| D.Ⅳ图中:水可以充满试管 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.滴加少量Na2CO3溶液,若有沉淀说明CO2一定不足 |
| B.滴加少量盐酸,若有气泡,CO2一定过量 |
| C.测量溶液pH,若大于7,CO2一定不足量 |
| D.滴加少量BaCl2溶液,若无沉淀,CO2一定没有过量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com