

| 滴定次数 | 样品的质量/g | KMnO4溶液的体积/mL | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 0.3000 | 1.02 | 24.04 |
| 2 | 0.3000 | 2.00 | 25.03 |
| 3 | 0.3000 | 0.20 | 23.24 |
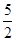 n(KMnO4)
n(KMnO4)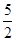 ×0.0200 mol·L—1×23.03mL×10—3L·mL—1(1分)
×0.0200 mol·L—1×23.03mL×10—3L·mL—1(1分)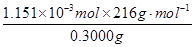 ×100%=82.91%(1分)
×100%=82.91%(1分)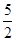 n(KMnO4)
n(KMnO4)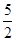 ×0.0200 mol·L—1×23.03mL×10—3L·mL—1(1分)
×0.0200 mol·L—1×23.03mL×10—3L·mL—1(1分)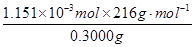 ×100%=82.91%
×100%=82.91%

 阅读快车系列答案
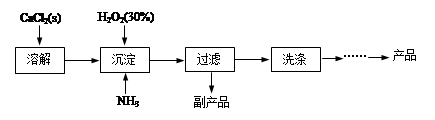
阅读快车系列答案科目:高中化学 来源:不详 题型:实验题
| A.亚硫酸钠 | B.KOH | C.醋酸 | D.Fe(NO3)3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
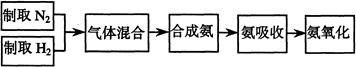
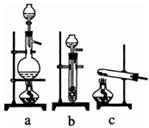
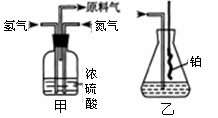
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
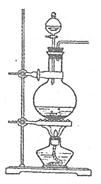
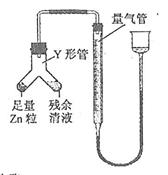
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
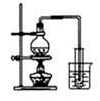 |  | 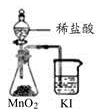 | 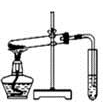 |
| A.制取少量蒸馏水 | B.制取少量NO2 | C.比较MnO2、Cl2、I2的氧化性 | D.探究NH4HCO3的热稳定性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
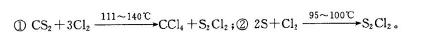 已知在S2Cl2中硫元素显+1价,电子式:
已知在S2Cl2中硫元素显+1价,电子式: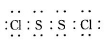 ,它不稳定,在水中易发生歧化反应 (一部分硫元素价态升高,一部分降低)。反应涉及的几种物质的熔沸点如下:
,它不稳定,在水中易发生歧化反应 (一部分硫元素价态升高,一部分降低)。反应涉及的几种物质的熔沸点如下: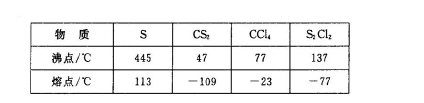
| A.石油分馏 | B.制备乙烯 | C.制取乙酸乙酯 | D.制取溴苯 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
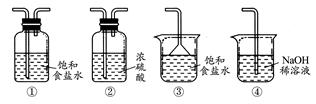
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
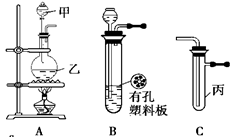

| 实验序号 | 实验操作 | 现 象 | 结 论 |
| Ⅰ | 将氯水滴入品红溶液 | 溶液褪色 | 氯气与水反应的产物有漂白性 |
| Ⅱ | 氯水中加入 NaHCO3粉末 | 有无色气泡产生 | 氯气与水反应的产物具有较强的酸性 |
| 实验序号 | 结论 | 理由 |
| Ⅰ | | |
| Ⅱ | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
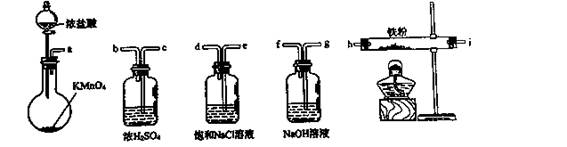
| A.a-b-c-d-e-e-f-g-h | B.a-e-d-c-b-h-i-g |
| C.a-d-e-c-b-h-i-g | D.a-c-b-d-e-h-i-f |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com