
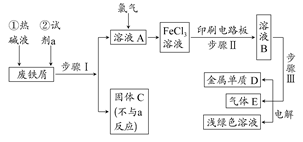
 Mn2++Cl2↑+2H2O;②④
Mn2++Cl2↑+2H2O;②④

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
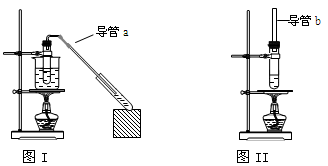
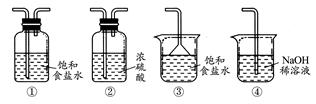
| A.图I装置用于制取乙酸乙酯,图II 装置用于制取乙酸丁酯 |
| B.导管a和导管b的作用都是冷凝回流 |
| C.都可用饱和Na2CO3溶液来洗去酯中的酸和醇 |
| D.加入过量的乙酸可以提高醇的转化率 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
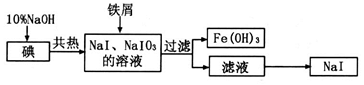
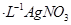 溶液滴定至终点,消耗
溶液滴定至终点,消耗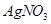 溶液体积的平均值为19.00mL。
溶液体积的平均值为19.00mL。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
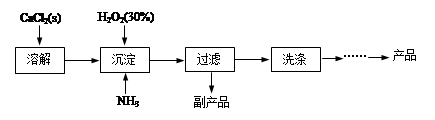

| 滴定次数 | 样品的质量/g | KMnO4溶液的体积/mL | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 0.3000 | 1.02 | 24.04 |
| 2 | 0.3000 | 2.00 | 25.03 |
| 3 | 0.3000 | 0.20 | 23.24 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
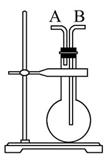
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
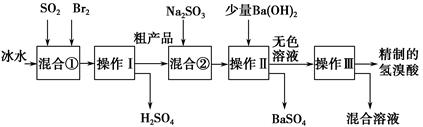
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com