
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,2. 24 L Cl2溶于水充分反应,转移的电子数为0.1NA
B.25℃时,pH =13的Ba(OH)2溶液中,OH-数目为0. 2NA
C.5.4 gAl分别与浓度均为2 mol.L-1的NaOH溶液和盐酸各100 mL反应,生成H2的分子数均为0.3.NA
D.31 g白磷(P4)分子中含有P-P键数目为1.5NA
【答案】D
【解析】
A. 标准状况下,2.24LCl2为1mol,但氯气与水的反应Cl2+H2OH++Cl-+HClO为可逆反应,则转移的电子数小于0.1NA,A项错误;
B. 缺少溶液的体积,无法计算OH-的数目,B项错误;
C. 5.4g Al的物质的量为0.2mol,100mL 2mol.L-1的NaOH溶液和盐酸溶质各0.2mol,而由于2Al6HCl3H2,2Al2NaOH3H2,故0.2mol铝与0.2mol氢氧化钠能恰好完全反应,而与0.2mol盐酸反应时,铝过量,由于反应掉的铝的物质的量不同,故生成的氢气分子个数不同,C项错误;
D. 31g白磷(P4)的物质的量为![]() ,1个白磷分子中含有6个P-P键,则0.25mol白磷分子中含有P-P键数目为0.25mol×6×NA =1.5NA,D项正确;
,1个白磷分子中含有6个P-P键,则0.25mol白磷分子中含有P-P键数目为0.25mol×6×NA =1.5NA,D项正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】工业上用CO生产燃料甲醇。一定温度和容积条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。图1表示反应中的能量变化;图2表示一定温度下,在体积为1L的密闭容器中加入2mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
CH3OH(g)。图1表示反应中的能量变化;图2表示一定温度下,在体积为1L的密闭容器中加入2mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。

请回答下列问题:
(1)在“图1”中,曲线____填“a”或“b”)表示使用了催化剂;没有使用催化剂时,在该温度和压强条件下反应CO(g)+2H2(g)![]() CH3OH(g)的△H= _________________________ 。
CH3OH(g)的△H= _________________________ 。
(2)下列说法正确的是 (_________)
A.起始充入的CO的物质的量为1mol
B.增加CO的浓度,H2的转化率会增大
C.容器中压强恒定时,反应达到平衡状态
(3)从反应开始到建立平衡,υ(CO)= _______;达到平衡时,c(H2)= ____ ,该温度下CO(g)+2H2(g) ![]() CH3OH(g)的化学平衡常数为______________。达到平衡后若保持其它条件不变,将容器体积压缩为0.5L,则平衡___________移动 (填“正向”、“逆向”或“不”)。
CH3OH(g)的化学平衡常数为______________。达到平衡后若保持其它条件不变,将容器体积压缩为0.5L,则平衡___________移动 (填“正向”、“逆向”或“不”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.05mol·L-1的某稀酸H2B溶液中滴入0.1mol·L-1氨水,溶液中由水电离出氢离子浓度随滴入氨水体积变化如图。下列分析正确的是( )

A. NaHB溶液可能为酸性,也可能为碱性
B. A、B、C三点溶液的pH是逐渐减小,D、E、F三点溶液的pH是逐渐增大
C. E溶液中离子浓度大小关系:c(NH4+)>c(B2-)>c(OH-)>c(H+)
D. F点溶液c(NH4+)=2c(B2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配合物Fe(CO)5的熔点一20℃,沸点103℃。可用于制备纯铁。Fe(CO)5的结构如图所示。

(1)基态Fe原子的价电子排布式是_____________________;Fe(CO)5晶体类型属于__________晶体。
(2)CO分子中C、O原子都满足8电子稳定结构,CO分子的结构式是________,写出与CO互为等电子体的分子的电子式:___________________。
(3)C、O、Fe的第一电离能由大到小的顺序为_______________________。
(4)关于Fe(CO)5,下列说法正确的是______。
A. Fe(CO)5是非极性分子,CO是极性分子 B. Fe(CO)5中Fe原子以sp3杂化方式与CO成键
C.1molFe(CO)5含有10mol配位键 D.Fe(CO)5==Fe+5CO反应中没有新化学键生成
(5)铁的三种晶体的晶胞均为立方晶胞,三种晶体的晶胞如下图所示。

①上述三种晶体的晶胞中属于面心晶胞的是______(填“a”“δ””或“γ”)-Fe。
②a-Fe晶胞中铁原子的配位数为_______________。
③γ-Fe晶胞的边长为apm,则γ-Fe单质的密度为____g/cm3(NA表示阿伏伽德罗常数的值,列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟碳铈矿(主要成分为CeFCO3)是提取稀土化合物、冶炼铈的重要矿物原料,以氟碳铈矿为原料提取铈的工艺流程如图所示。
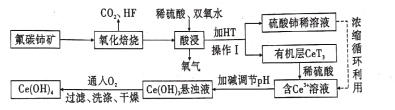
回答下列问题:
(l)CeFCO3中Ce的化合价为____ 。
(2)氧化培烧时不能使用陶瓷容器,原因是________.。
(3)氧化焙烧后的产物之一为CeO2.则酸浸时发生反应的离子方程式为____。
(4)HT是一种难溶于水的有机溶剂,则操作I的名称为 _____。
(5)为了提高酸浸率,可以适当提高反应温度,但温度偏高浸出率反而会减小,其原因是____。
(6)有机物HT能将Ce3+从水溶液中萃取出来,该过程可表示为Ce3+(水层)+3HT(有机层) ![]() CeT3(有机层)+3H+(水层)。向CeT3(有机层)中加入稀硫酸能获得较纯的含Ce3+的水溶液,从平衡角度解释其原因________。
CeT3(有机层)+3H+(水层)。向CeT3(有机层)中加入稀硫酸能获得较纯的含Ce3+的水溶液,从平衡角度解释其原因________。
(7)写出向Ce(OH)3悬浊液中通入氧气得到产品Ce(OH)4的化学方程式:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将打磨后的镁条放入盛有50ml蒸馏水的烧杯后,用pH传感器和浊度传感器监测溶液中pH和溶液浊度随时间的变化如图。下列有关描述正确的( )
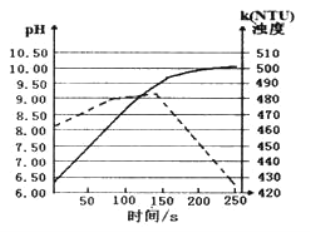
A.该实验是在常温下进行的
B.实线表示溶液浊度随时间的变化
C.50s时向溶液中滴入酚酞试液,溶液变红
D.150s后溶液浊度下降是因为生成的Mg(OH)2沉降
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸亚乙酯是一种重要的添加剂,其结构简式为![]() 。用环氧乙烷合成碳酸亚乙酯的反应为:
。用环氧乙烷合成碳酸亚乙酯的反应为: 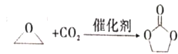 下列说法错误的是
下列说法错误的是
A.碳酸亚乙酯中的所有原子处于同一平面内B.碳酸亚乙酯的二氯代物只有两种
C.上述反应属于加成反应D.1 mol碳酸亚乙酯最多可消耗2 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某密闭容器中加入 0.3 mol A、0.1 mol C 和一定量的 B 三种气体, 一定条件下发生如下反应: 3A(g) ![]() B(g)+2C(g),各物质的浓度随时间变化如图所示[t0~t1 阶段的 c(B)变化未画出]。下列说法中正确的是( )
B(g)+2C(g),各物质的浓度随时间变化如图所示[t0~t1 阶段的 c(B)变化未画出]。下列说法中正确的是( )

A. 若 t1=15 s,则用 A 的浓度变化表示 t0~t1阶段的平均反应速率为 0.004 mol·L-1·s-1
B. t1时该反应达到平衡, A 的转化率为 60%
C. 该容器的容积为2 L,B的起始的物质的量为 0.02 mol
D. t0~t1 阶段, 此过程中容器与外界的热交换总量为 a kJ,该反应的热化学方程式为 3A(g)![]() B(g)+2C(g) ΔH=-50a kJ·mol-1
B(g)+2C(g) ΔH=-50a kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过渡态理论认为:化学反应并不是通过简单的碰撞就能完成的,而是从反应物到生成物的过程中经过一个高能量的过渡态.如图I是1molNO2与1molCO恰好反应生成CO2和NO过程中的能量变化示意图。
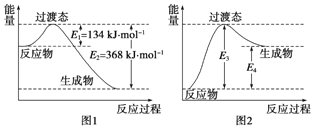
(1)试写出NO2 和CO反应的热化学方程式:____.该反应的活化能是___kJ·mol-1
(2) 图2 是某学生模仿图l画出的NO(g)+CO2(g)= NO2(g)十CO(g)的能量变化示意图。则图中E3=_kJ·mol-1,E4=____ kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com