
【题目】碳酸亚乙酯是一种重要的添加剂,其结构简式为![]() 。用环氧乙烷合成碳酸亚乙酯的反应为:
。用环氧乙烷合成碳酸亚乙酯的反应为: 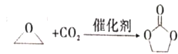 下列说法错误的是
下列说法错误的是
A.碳酸亚乙酯中的所有原子处于同一平面内B.碳酸亚乙酯的二氯代物只有两种
C.上述反应属于加成反应D.1 mol碳酸亚乙酯最多可消耗2 mol NaOH
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】实验测得BH3为平面三角形(键角均为120°),NH3为三角锥型(键角为107.3°),已知电子数相同的微粒具有相似的结构。由此推断:①甲基,②甲基碳正离子(![]() ),③甲基碳负离子(
),③甲基碳负离子(![]() )的键角相对大小顺序为( )
)的键角相对大小顺序为( )
A.②>①>③B.①>②>③
C.③>①>②D.①=②=③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列叙述正确的有________。
A.蚕丝、棉花和羊毛的主要成分都是纤维素
B.我们平时吃的豆腐中主要含有蛋白质
C.“病毒感冒”的元凶是一种油脂
D.生物实验室一般用质量分数为40%甲醛水溶液保存生物标本
(2)如果发现有人误服重金属盐而出现了轻微中毒症状,需要马上对病人进行抢救。
①你认为下列物质可以利用的有________。
A.碳酸钡 B.豆浆 C.碘酒 D.熟鸡蛋 E.酒精 F.生牛奶
②当你用所选物质对病人进行抢救以后,下一步的做法是________。
A.建议病人尽快去医院治疗
B.将病人安置于通风处呼吸新鲜的空气
C.建议病人卧床休息
(3)血液中有一种含铜的呈蓝色的蛋白质分子,其相对分子质量约为151000。已知该蛋白质分子中铜的质量分数为0.34%,平均每个该蛋白质分子中铜原子的个数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,2. 24 L Cl2溶于水充分反应,转移的电子数为0.1NA
B.25℃时,pH =13的Ba(OH)2溶液中,OH-数目为0. 2NA
C.5.4 gAl分别与浓度均为2 mol.L-1的NaOH溶液和盐酸各100 mL反应,生成H2的分子数均为0.3.NA
D.31 g白磷(P4)分子中含有P-P键数目为1.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验方案能达到实验目的的是
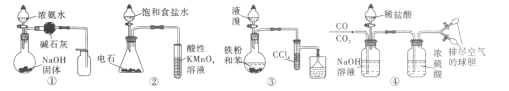
A.用图①的装置制取并收集干燥的NH3B.用图②的装置验证乙炔的还原性
C.用图③的装置制取溴苯D.用图④的装置分离CO和CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚砷酸(H3AsO3)可以用于治疗白血病,在溶液中存在多种微粒形态。向1L0.1mol·L-1H3AsO3溶液中逐滴加入KOH溶液,各种微粒物质的量分数与溶液的pH 关系如下图所示。下列说法正确的是( )
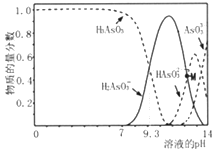
A. H3AsO3的电离常数Ka1的数量级为10-9
B. pH在8.0~10.0时,反应的离子方程式:H3AsO3+OH-=H2AsO3-+H2O
C. M点对应的溶液中:c(H2AsO3-)+c(HAsO32-)+c(AsO33-)+c(H3AsO3)=0.1mol·L-1
D. pH=12时,溶液中:c(H2AsO3-)+2c(HAsO32-)+3c(AsO33-)+c(H3AsO3)>c(H+)+c(K+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C是与植物生命活动密切相关的三种常见化合物,每种物质所含元素种类均不超过三种,甲是单质,有机物D也是生活中常见的物质,在一定条件下可发生如下反应:![]() 。它们之间有如图所示的转化关系:
。它们之间有如图所示的转化关系:
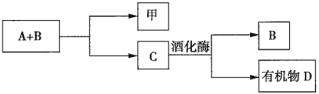
(1)在化合物A、B、C、D中所含元素种类完全相同的是________(填序号,下同)和________。
(2)在常温下,A和B通过________转化为C。该过程中________能转化为________能。
(3)写出由C生成D的化学方程式:________________。
(4)目前化合物B在大气中的含量呈上升趋势,其对环境造成的影响是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨在工农业及国防工业上有广泛的用途。
(1)已知:
①4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) △H=-1266.2k/mol
2N2(g)+6H2O(g) △H=-1266.2k/mol
②2H2(g)+O2(g)![]() 2H2O(g) △H=-483.6kJ/mol
2H2O(g) △H=-483.6kJ/mol
则合成氨反应N2(g)+3H2(g)![]() 2NH3(g) △H=___________kJ/mol,该反应属于___________。
2NH3(g) △H=___________kJ/mol,该反应属于___________。
A.高温自发 B.低温自发 C.恒自发 D.恒不自发
(2)在甲、乙、丙三个容积均为2L的密闭装置中,均充人4mol合成气,但N2、H2的投料比不同,在400℃时反应,测定N2的体积百分含量,得到下图一。
①乙装置中N2、H2的投料比为___________。
②反应达到平衡后,测得乙装置中H2的体积百分含量为25%,则400℃时,合成氨反应的平衡常数为___________(不须注明单位)。
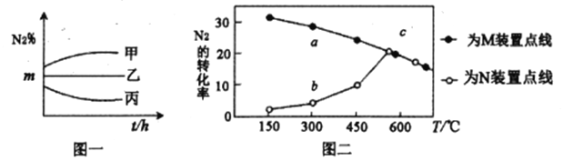
(3)在M、N两个装置中分别充入相同投料比的N2、H2,进行合成氨反应,各反应1小时,测定不同温度下N2的转化率,得到上图二。
①N2、H2在M、N两装置中反应时,不同的条件可能是______________________。
②在300℃时,a、b两点转化率差异的原因是______________________。
(4)氨法烟气脱硫技术渐趋成熟,回收SO2,并产出氮肥,其流程分两步:
①氨水吸收烟气中的SO2:xNH3+SO2(g)+H2O====(NH4)xH2-xSO3
②加入足量的磷酸得到纯净的SO2。写出该反应的化学方程式:______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com