
【题目】用下列实验方案能达到实验目的的是
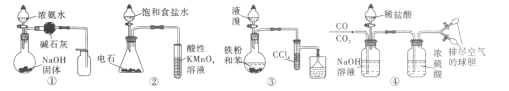
A.用图①的装置制取并收集干燥的NH3B.用图②的装置验证乙炔的还原性
C.用图③的装置制取溴苯D.用图④的装置分离CO和CO2
【答案】C
【解析】
A. 氨气的密度比空气密度小,图中氨气的收集方法不合理,应用向下排空气法收集,A项错误;
B. 乙炔及混有的硫化氢均使高锰酸钾褪色,由溶液褪色,不能说明乙炔的还原性,B项错误;
C. 苯和溴发生取代反应生成溴苯,四氯化碳可吸收挥发出的溴单质,烧杯中吸收尾气且防止倒吸,则图中装置可制备溴苯,C项正确;
D. 将CO、CO2混合气体通入氢氧化钠溶液中,CO2会与氢氧化钠反应生成碳酸钠,剩余的CO通过浓硫酸干燥,可将其收集在Y形管所连的上边的球胆中,再将稀盐酸滴入碳酸钠溶液中,可发生反应生成CO2,将其通过浓硫酸进行干燥,收集在下边的球胆中,但是稀盐酸易挥发,CO2中会混有HCl气体,则用图④的装置不能分离CO和CO2,可换用稀硫酸实现目的,D项错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】下列属于氧化还原反应的是( )
A.MgCl2 + Ba(OH)2 == BaCl2 + Mg(OH)2↓B.CO2 + 2NaOH == Na2CO3 + H2O
C.CaCO3 ![]() CaO + CO2↑D.H2 + CuO ==H2O + Cu
CaO + CO2↑D.H2 + CuO ==H2O + Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辛烷(C8H18)是汽油的重要成分,其与O2反应的能量变化如图所示。下列判断正确的是
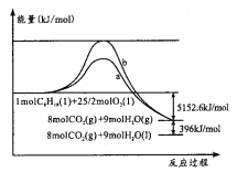
A. 曲线b代表加入催化剂时的能量变化
B. 反应物的总能量小于生成物的总能量
C. 表示辛烷燃烧热的热化学方程式:C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(g) ΔH=-5152.6kJ/mol
D. 反应a、b的活化能不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟碳铈矿(主要成分为CeFCO3)是提取稀土化合物、冶炼铈的重要矿物原料,以氟碳铈矿为原料提取铈的工艺流程如图所示。
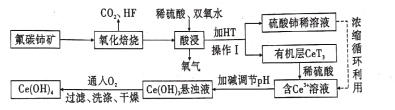
回答下列问题:
(l)CeFCO3中Ce的化合价为____ 。
(2)氧化培烧时不能使用陶瓷容器,原因是________.。
(3)氧化焙烧后的产物之一为CeO2.则酸浸时发生反应的离子方程式为____。
(4)HT是一种难溶于水的有机溶剂,则操作I的名称为 _____。
(5)为了提高酸浸率,可以适当提高反应温度,但温度偏高浸出率反而会减小,其原因是____。
(6)有机物HT能将Ce3+从水溶液中萃取出来,该过程可表示为Ce3+(水层)+3HT(有机层) ![]() CeT3(有机层)+3H+(水层)。向CeT3(有机层)中加入稀硫酸能获得较纯的含Ce3+的水溶液,从平衡角度解释其原因________。
CeT3(有机层)+3H+(水层)。向CeT3(有机层)中加入稀硫酸能获得较纯的含Ce3+的水溶液,从平衡角度解释其原因________。
(7)写出向Ce(OH)3悬浊液中通入氧气得到产品Ce(OH)4的化学方程式:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,H2CO3 的 Kal=4.2×10-7,Ka2=5.6×10-11。室温下向10mL 0.1 mo1·L-1 Na2CO3 中逐滴加入 0.1 mo1·L-1 HCl。右图是溶液中含 C微粒物质的量分数随 pH降低而变化的
图像(CO2 因有逸出未画出)。下列说法错误的是
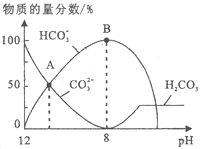
A. A点溶液的pH<11
B. B点溶液:c(Na+)= c(HCO3-)+ c(CO32-)+ c(H2 CO3)
C. A→B 的过程中,离子反应方程式为:CO32-+H+=H CO3-
D. 分步加入酚酞和甲基橙,用中和滴定法可测定Na2CO3与NaHCO3混合物组成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸亚乙酯是一种重要的添加剂,其结构简式为![]() 。用环氧乙烷合成碳酸亚乙酯的反应为:
。用环氧乙烷合成碳酸亚乙酯的反应为: 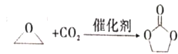 下列说法错误的是
下列说法错误的是
A.碳酸亚乙酯中的所有原子处于同一平面内B.碳酸亚乙酯的二氯代物只有两种
C.上述反应属于加成反应D.1 mol碳酸亚乙酯最多可消耗2 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。
根据题意完成下列填空:
(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为_______。
(2)上述反应中的氧化剂是_______,反应产生的气体可用_______吸收。
(3)As2S3和HNO3有如下反应:As2S3 + 10H++ 10NO3-→2H3AsO4 + 3S+ 10NO2↑+ 2H2O
若生成2mol H3AsO4,则反应中转移电子的物质的量为_______。若将该反应设计成原电池,则NO2应该在____(填“正极”或“负极”)附近逸出。
(4)若反应产物NO2与11.2L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量____(选填编号)。
a.小于0.5 mol b.等于0.5 mol c.大于0.5 mol d.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】兴趣小组探究SO2气体还原Fe3+、I2,它们使用的药品和装置如图所示:
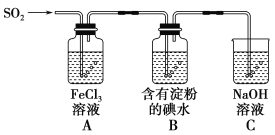
(1)SO2气体和Fe3+反应的氧化产物、还原产物分别是________、________
(2)下列实验方案适用于在实验室制取所需SO2的是________。
A.Na2SO3溶液与HNO3 B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧 D.铜与浓H2SO4共热
(3)装置C的作用是__________________________________________________。
(4)装置B中反应的离子方程式_________________________________________________。
(5)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入酸性KMnO4溶液,紫红色褪去。
方案②:往第二份试液中加入NaOH溶液,产生白色沉淀,并迅速转为灰绿,最后呈红褐色。
方案③:往第三份试液中加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是方案_____,原因是__________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近日,我国科研团队研发出一种蓝藻人造叶片系统,其核心是一种可以向细胞外分泌蔗糖的蓝藻,其工作原理如图。下列说法不正确的是

A. 该系统利用了蓝藻的光合作用
B. 理论上,系统出水量小于进水量
C. 可用银氨溶液检验产物中是否含蔗糖
D. 该系统有望为人类探索太空时解决生存难题提供新思路
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com