
【题目】25℃时,H2CO3 的 Kal=4.2×10-7,Ka2=5.6×10-11。室温下向10mL 0.1 mo1·L-1 Na2CO3 中逐滴加入 0.1 mo1·L-1 HCl。右图是溶液中含 C微粒物质的量分数随 pH降低而变化的
图像(CO2 因有逸出未画出)。下列说法错误的是
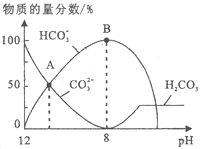
A. A点溶液的pH<11
B. B点溶液:c(Na+)= c(HCO3-)+ c(CO32-)+ c(H2 CO3)
C. A→B 的过程中,离子反应方程式为:CO32-+H+=H CO3-
D. 分步加入酚酞和甲基橙,用中和滴定法可测定Na2CO3与NaHCO3混合物组成
【答案】B
【解析】A、A点c(HCO3-)= c(CO32-),Ka2=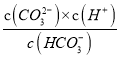 = 5.6×10-11,所以c(H+)=5.6×10-11mol/L,pH<11,选项A正确;B、室温下向10mL 0.1 mo1·L-1 Na2CO3 中逐滴加入 0.1 mo1·L-1 HCl,B点溶液中钠离子的物质的量浓度是含碳粒子浓度的2倍,即c(Na+)=2 c(HCO3-)+ 2c(CO32-)+ 2c(H2 CO3),选项B错误;C、A→B 的过程中,CO32-逐渐减小,H CO3-逐渐增加,所以发生反应的离子方程式为:CO32-+H+=H CO3-,选项C正确;D、Na2CO3溶液中逐滴加入盐酸,用酚酞作指示剂,滴定产物是碳酸氢钠,用甲基橙作指示剂滴定时碳酸氢钠与盐酸反应产物是碳酸,所以分步加入酚酞和甲基橙,用滴定法可测定Na2CO3与NaHCO3混合物组成,选项D正确。答案选B。
= 5.6×10-11,所以c(H+)=5.6×10-11mol/L,pH<11,选项A正确;B、室温下向10mL 0.1 mo1·L-1 Na2CO3 中逐滴加入 0.1 mo1·L-1 HCl,B点溶液中钠离子的物质的量浓度是含碳粒子浓度的2倍,即c(Na+)=2 c(HCO3-)+ 2c(CO32-)+ 2c(H2 CO3),选项B错误;C、A→B 的过程中,CO32-逐渐减小,H CO3-逐渐增加,所以发生反应的离子方程式为:CO32-+H+=H CO3-,选项C正确;D、Na2CO3溶液中逐滴加入盐酸,用酚酞作指示剂,滴定产物是碳酸氢钠,用甲基橙作指示剂滴定时碳酸氢钠与盐酸反应产物是碳酸,所以分步加入酚酞和甲基橙,用滴定法可测定Na2CO3与NaHCO3混合物组成,选项D正确。答案选B。


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
【题目】中学常见的短周期主族元素R、X、Y、Z、M的原子序数依次增大,它们占据三个周期。Y和M位于同主族,Y原子最外层电子数是电子层数的3倍。这五种元素组成一种离子化合物Q,取一定量Q溶于蒸馏水得到溶液,向溶液中滴加稀氢氧化钠溶液,产生的沉定与氢氧化钠溶液体积的关系如图所示。下列说法不正确的是
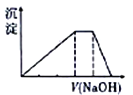
A. 气态氢化物的沸点:Y>X
B. R与除Z以外的其他3种元素均能形成共价化合物
C. 简单离子的半径:M>Y>Z
D. Y与其他4种元素均可形成至少两种二元化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化中释放能量的是( )
A. 1s22s22p63s1→1s22s22p6
B. N≡N(g)→N(g)+N(g)
C. 2p2p2p→2p2p2p
D. 2H(g)→H-H(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁及其化合物是实验设计的热点载体,查阅资料。
ⅰ | 2NO2+2NaOH=NaNO2+NaNO3+H2O |
ⅱ | Mg3N2与水反应 |
ⅲ | 常温下,NH3·H2O、CH3COOH的电离常数都等于1.8×10-5 |
Ⅰ.探究镁的性质。
某学习小组设计实验探究镁与二氧化氮反应的产物,实验装置如图所示。
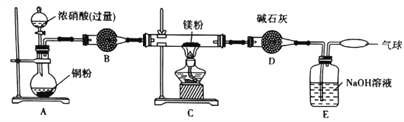
(1)B中试剂是_____________;D装置的作用是______________________________。
(2)实验时,先启动A中反应,当C装置中充满红棕色气体时点燃酒精灯,这样操作的目的是____________________________________________________________________________。
(3)确定有N2生成的实验现象是_______________________________________________________。
(4)实验完毕后,设计实验确认产物中有Mg3N2取少量C中残留固体于试管中,滴加蒸馏水,_____________________,则产物中有氮化镁。
(5)经测定,Mg与NO2反应生成MgO、Mg3N2和N2,其中Mg3N2和N2的物质的量相等。C中发生反应的化学方程式为_____________________________________________________。
Ⅱ.探究Mg(OH)2在氯化铵溶液中溶解的原因。供选试剂有:氢氧化镁、蒸馏水、硝酸氨溶液、盐酸、醋酸铵溶液。
取少量氢氧化镁粉末投入氯化氨溶液中,振荡、白色粉末全部溶解。为了探究其原因,他们提出两种假设。
假设1:氯化铵溶液呈酸性,H++OH-=H2O,促进Mg(OH)2溶解;
假设2:NH4++OH-=NH3·H2O,促进Mg(OH)2溶解。
(6)请你帮他们设计实验探究哪一种假设正确:____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,杠杆 AB 两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠 杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓 CuSO4 溶液,一段时间后,下列 有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)
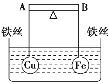
A. 杠杆为导体和绝缘体时,均为 A 端高 B 端低
B. 杠杆为导体和绝缘体时,均为 A 端低 B 端高
C. 当杠杆为绝缘体时,A 端低 B 端高;为导体时,A 端高 B 端低
D. 当杠杆为绝缘体时,A 端高 B 端低;为导体时,A 端低 B 端高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C60具有完美的球形结构。之后Si60、N60等球形分子被不断制备出来。回答下列问题:
(1)Si的核外电子排布式为_______,C和N元素中第一电离能较大的是_______。
(2)富勒烯衍生物具有良好的光电性能,富勒烯(C60)的结构如右图所示,C60属于___晶体;C60分子中五元环与六元环的数目比为_____。
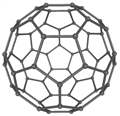
(已知简单多面体的顶点数V、棱数E及面数F间有如下关系:V-E+F=2)。
(3)N60的晶体中存在的作用力有_____(填字母标号)
A.共价键 B.离子键 C.氢键
D.范德华力 E.配位键 F.金属键
(4)立方氮化硼(BN)可做磨料,其结构与金刚石相似,二者具有相似性结构的原因是_______。
(5)金属M(相对原子质量为m)与N60形成的化合物晶体结构如右图所示(其中白球代表N60,黑球代表金属M),若其晶胞边长为k pm,NA代表阿伏加德罗常数的值,则其密度为______g·cm-3,该化合物中N60的配位数为______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中(假定不考虑水解因素)仅含有K+、Mg2+、SO42-、NO3-四种离子,其中K+与Mg2+的个数之比为4∶5,则NO3-与SO42-的物质的量浓度之比一定不是
A.8∶3B.3∶2C.2∶3D.1∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A含有C、H、O三种元素,6.2g完全燃烧后将产物经过浓H2SO4,浓硫酸质量增重5.4g;剩余气体再通过碱石灰被完全吸收,质量增加8.8g。经测定A的相对分子质量为62。(已知两个羟基连在同一个碳上不稳定会自动失去一个水)
(1)试通过计算推断该有机物的分子式_________。
(2)若0.1mol该有机物恰好与4.6g金属钠完全反应,则该有机物的结构简式为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com