
【题目】镁及其化合物是实验设计的热点载体,查阅资料。
ⅰ | 2NO2+2NaOH=NaNO2+NaNO3+H2O |
ⅱ | Mg3N2与水反应 |
ⅲ | 常温下,NH3·H2O、CH3COOH的电离常数都等于1.8×10-5 |
Ⅰ.探究镁的性质。
某学习小组设计实验探究镁与二氧化氮反应的产物,实验装置如图所示。
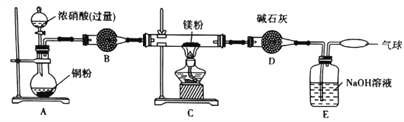
(1)B中试剂是_____________;D装置的作用是______________________________。
(2)实验时,先启动A中反应,当C装置中充满红棕色气体时点燃酒精灯,这样操作的目的是____________________________________________________________________________。
(3)确定有N2生成的实验现象是_______________________________________________________。
(4)实验完毕后,设计实验确认产物中有Mg3N2取少量C中残留固体于试管中,滴加蒸馏水,_____________________,则产物中有氮化镁。
(5)经测定,Mg与NO2反应生成MgO、Mg3N2和N2,其中Mg3N2和N2的物质的量相等。C中发生反应的化学方程式为_____________________________________________________。
Ⅱ.探究Mg(OH)2在氯化铵溶液中溶解的原因。供选试剂有:氢氧化镁、蒸馏水、硝酸氨溶液、盐酸、醋酸铵溶液。
取少量氢氧化镁粉末投入氯化氨溶液中,振荡、白色粉末全部溶解。为了探究其原因,他们提出两种假设。
假设1:氯化铵溶液呈酸性,H++OH-=H2O,促进Mg(OH)2溶解;
假设2:NH4++OH-=NH3·H2O,促进Mg(OH)2溶解。
(6)请你帮他们设计实验探究哪一种假设正确:____________________________________________。
【答案】 P2O5等 吸收E中挥发出来的水蒸气 排尽装置内空气,避免O2、CO2、N2等与镁反应 E中产生气泡,瘪气球缓慢鼓起 有刺激性气味的气体逸出(产生的气体能使湿润红色石蕊试纸变蓝色) 11Mg+4NO2![]() 8MgO+Mg3N2+N2(写成4Mg+2NO2
8MgO+Mg3N2+N2(写成4Mg+2NO2![]() 4MgO+N2、3Mg+N2
4MgO+N2、3Mg+N2![]() Mg3N2也给分) 取少量氢氧化镁于试管中,加入足量CH3COONH4溶液,若白色固体溶解,则假设2正确;若白色固体不溶解,则假设1正确
Mg3N2也给分) 取少量氢氧化镁于试管中,加入足量CH3COONH4溶液,若白色固体溶解,则假设2正确;若白色固体不溶解,则假设1正确
【解析】(1)B中试剂用于干燥二氧化氮,由于二氧化氮与水反应生成酸,故不能用碱性干燥剂,应选择酸性或中性干燥剂,可以是P2O5等;D装置的作用是吸收E中挥发出来的水蒸气(防止E中水蒸气进入C装置的玻璃管中干扰实验)。
(2)实验时,先启动A中反应,当C装置中充满红棕色气体时点燃酒精灯,这样操作的目的是排尽装置内空气,避免O2、CO2、N2等与镁反应。
(3)依据题中信息,过量的二氧化氮可以被氢氧化钠溶液吸收,所以确定有N2生成的实验现象是E中产生气泡,瘪气球缓慢鼓起。
(4)实验完毕后,设计如下实验确认产物中有Mg3N2:取少量C中残留固体置于试管中,滴加蒸馏水,有刺激性气味的气体逸出(产生的气体能使湿润红色石蕊试纸变蓝色),则产物中有氮化镁。
(5)经测定,Mg与NO2反应生成MgO、Mg3N2和N2,其中Mg3N2和N2的物质的量相等,所以C中发生反应的化学方程式为11Mg+4NO2![]() 8MgO+Mg3N2+N2。
8MgO+Mg3N2+N2。
(6)由题中信息可知,常温下,NH3·H2O、CH3COOH的电离常数相同,所以CH3COONH4溶液显中性。因此,可以设计如下实验:取少量氢氧化镁置于试管中,加入足量CH3COONH4溶液,若白色固体溶解,则假设2正确;若白色固体不溶解,则假设1正确。


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】某温度下,将一定量碳酸氢铵固体置于容积不变密闭容器中,发生反应:
NH4HCO3(s)![]() NH3(g)+H2O(g)+CO2(g) △H=QkJ/mol(Q>0)。下列有关说法不正确的是
NH3(g)+H2O(g)+CO2(g) △H=QkJ/mol(Q>0)。下列有关说法不正确的是
A. 若容器内混合气体的密度不变,则说明反应达到平街状态
B. 若CO2体积分数不再发生变化,则说明反应达到平街状态
C. 若升高体系温度,则正、逆反应速率均增大
D. 若反应过程中吸收QkJ热量,则刚好有lmol NH4HCO3发生分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M均为短周期元素,它们在周期表中的位置如下图。若Y原子的最外层电子数是次外层电子数的3倍。下列说法中正确的是
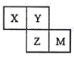
A. 原子半径:X<Y<Z<M
B. 最简单气态氢化物的热稳定性:Y<Z
C. 最高价氧化物对应水化物的酸性:Z<M
D. X与Y形成的化合物均易溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应的快慢和限度对人类生产、生活有重要的意义。
(1)将影响化学反应速率的因素镇在空格处。
实例 | 影响因素 |
食物放在冰箱里延长保质期 | ①___ |
实验室将块状药品研细,再进行反应 | ②___ |
(2)某小组将酸性KMnO4溶液与H2C2O4(具有还原性)溶液混合,用反应中溶液紫色消失快慢的方法研究形响化学反应速率的因素。实验中酸性KMnO4溶液(0.0010mol/L)、H2C2O4溶液的用量均为4mL(忽略加入固体,溶液混合时体积的变化)。
①该反应中氧化剂与还原剂的物质的量之比为________。
②请帮助他们完成以下实验设计表:填写IV中的数据,并将实验目的补充完整。
实验编号 | 温度/K | 催化剂的用量/g | H2C2O4溶液的浓度/mol.L-1 | 实验目的 |
I | 298 | 0.5 | 0.010 | A.实验I和II探究____对反应速率的影响 B.实验I和III探究____对反应速率的影响 C.实验I和IV探究催化剂对反应速率的影响 |
II | 298 | 0.5 | 0.050 | |
III | 323 | 0.5 | 0.010 | |
IV | ____ | ____ | ____ |
③该小组同学对实验II进行了3次实验,测得以下数据:
实验编号 | 溶液退色所需时问t/min | ||
第1次 | 第2次 | 第3次 | |
II | 4.9 | 5.1 | 5.0 |
实验II中用KMnO4表示该反应的平均反应速率为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(ClNO)是有机合成中常用的试剂。
巳知:①2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g)△H1=akJ·mol-1
NaNO3(s)+ClNO(g)△H1=akJ·mol-1
②4NO2(8)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)△H2=bkJ·mol-1
2NaNO3(s)+2NO(g)+Cl2(g)△H2=bkJ·mol-1
③2NO(g)+Cl2(g)![]() 2ClNO(g)△H3=ckJ·mol-1
2ClNO(g)△H3=ckJ·mol-1
(1)上述反应中,a、b、c之间满足的关系为_____________________。
(2)某温度下,在密闭容器中发生反应:2NO(g)+Cl2(g)![]() 2ClNO(g),正反应速率表达式为v正=k·cn(NO)·cm(Cl2)(k是反应速率常数,只与温度有关;n、m为反应级数,只取正数)。测得正反应速率与浓度的关系如下表所示:
2ClNO(g),正反应速率表达式为v正=k·cn(NO)·cm(Cl2)(k是反应速率常数,只与温度有关;n、m为反应级数,只取正数)。测得正反应速率与浓度的关系如下表所示:
序号 | c(NO)/mol·L-1 | c(Cl2)/mol·L-1 | v正/mol·L-1·min-1 |
ⅰ | 0.100 | 0.100 | 0.144 |
ⅱ | 0.100 | 0.200 | 0.288 |
ⅲ | 0.200 | 0.100 | 0.576 |
①n=_____________,m=_____________。
②反应达到平衡后,其他条件不变时,缩小容器体积瞬间,v正_____________v逆(填“>"“<”或“=")。NO的平衡转化率_____________(填“增大”“减小”或“不变”)。
(3)在2L恒容密闭容器中充入0.8molClNO(g),发生反应:2ClNO(g)![]() Cl2(g)+2NO(g) △H,测得c(Cl2)与温度和时间的关系如图1所示。300℃时达到平衡后,温度与平衡常数负对数(-lgK)的关系如图2所示。
Cl2(g)+2NO(g) △H,测得c(Cl2)与温度和时间的关系如图1所示。300℃时达到平衡后,温度与平衡常数负对数(-lgK)的关系如图2所示。
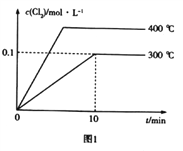
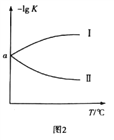
①a=_____________。
②图2中符合题意的曲线为_____________(填“Ⅰ”或“Ⅱ”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】垃圾假单胞菌株能够在分解有机物的同时分泌物质产生电能,其原理如下图所示。下列说法正确的是( )

A. 电流由左侧电极经过负载后流向右侧电极
B. 放电过程中,正极附近pH 变小
C. 若1molO2 参与电极反应,有4 mol H+穿过质子交换膜进入右室
D. 负极电极反应为:H2PCA + 2e-=PCA + 2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,H2CO3 的 Kal=4.2×10-7,Ka2=5.6×10-11。室温下向10mL 0.1 mo1·L-1 Na2CO3 中逐滴加入 0.1 mo1·L-1 HCl。右图是溶液中含 C微粒物质的量分数随 pH降低而变化的
图像(CO2 因有逸出未画出)。下列说法错误的是
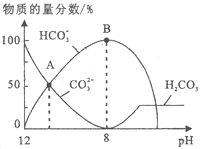
A. A点溶液的pH<11
B. B点溶液:c(Na+)= c(HCO3-)+ c(CO32-)+ c(H2 CO3)
C. A→B 的过程中,离子反应方程式为:CO32-+H+=H CO3-
D. 分步加入酚酞和甲基橙,用中和滴定法可测定Na2CO3与NaHCO3混合物组成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于胶体的叙述正确的是( )
A.胶体是不稳定的,静置后易产生沉淀
B.胶体与悬浊液的本质区别是胶体是均一透明的,而浊液是浑浊的
C.明矾净水是利用了胶体粒子的吸附性
D.静电除去空气或工厂废气中的飘尘是利用了胶体的带电性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列两种气体的分子数一定相等的是( )
A.等体积的CO和N2B.质量相等、密度不等的N2和CO
C.原子数目相等的O3和N2D.质量相等的N2和CO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com