
【题目】某温度下,将一定量碳酸氢铵固体置于容积不变密闭容器中,发生反应:
NH4HCO3(s)![]() NH3(g)+H2O(g)+CO2(g) △H=QkJ/mol(Q>0)。下列有关说法不正确的是
NH3(g)+H2O(g)+CO2(g) △H=QkJ/mol(Q>0)。下列有关说法不正确的是
A. 若容器内混合气体的密度不变,则说明反应达到平街状态
B. 若CO2体积分数不再发生变化,则说明反应达到平街状态
C. 若升高体系温度,则正、逆反应速率均增大
D. 若反应过程中吸收QkJ热量,则刚好有lmol NH4HCO3发生分解
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】现有浓度为1 mol/L的五种溶液:①HCl,②H2SO4 , ③CH3COOH,④NH4Cl,⑤NaOH,由水电离出的C(H+)大小关系正确的是( )
A.④>③>①=⑤>②
B.①=②>③>④>⑤
C.②>①>③>④>⑤
D.④>③>①>⑤>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在电解炼铝过程中加入冰晶石(用“A”代替),可起到降低Al2O3熔点的作用。冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO3=2A+3CO2↑+9H2O。根据题意完成下列填空:
(1)冰晶石的化学式为____________, 含有离子键、____________等化学键。
(2)生成物中含有10个电子的分子是________(写分子式),该分子的空间构型_______,中心原子的杂化方式为___________________。
(3)反应物中电负性最大的元素为________(填元素符号),写出其原子最外层的电子排布图:_______________。
(4)冰晶石由两种微粒构成,冰晶石的晶胞结构如图甲所示,●位于大立方体的顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处所代表的微粒是__________(填微粒符号)。
(5)Al单质的晶体中原子的堆积方式如图乙所示,其晶胞特征如图丙所示,原子之间相互位置关系的平面图如图丁所示:

若已知Al的原子半径为d,NA代表阿伏加德罗常数,Al的相对原子质量为M,则一个晶胞中Al原子的数目为___________个; Al晶体的密度为________(用字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究金属的腐蚀情况,某同学将锌片和铜片置于浸有饱和食盐水和酚酞的滤纸上,并构成如图所示的装置。下列判断合理的是( )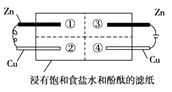
A.左边铜片上有气泡冒出
B.右边锌片上的反应为2Cl-- 2e-=Cl2↑
C.最先观察到红色的区域是②
D.两铜片质量均不发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表是元素周期表的一部分,参照元素在表中的位置,请用化学用语回答下列问题:
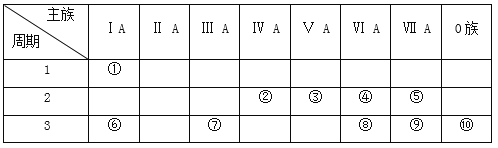
(1)在上述元素最高价氧化物对应水化物中,酸性最强的是_______________,碱性最强的是_____________,显两性的是_____________。(化学式)
(2)这些元素中,化学性质最不活泼原子的原子结构示意图为__________;气态氢化物中,最稳定的是_________(化学式),②③④⑤形成的氢化物中沸点最高的是_______(化学式)。
(3)①和④两种元素的原子按1:1组成的常见化合物的电子式为_____________。
(4)④、⑥、⑦、⑨的简单离子半径由大到小的顺序为______________________________(用离子符号和“>”表示)。
(5)⑥和⑦的最高价氧化物对应水化物之间发生反应的化学方程式_____________________。
(6)为了证明⑥和⑦两种元素的金属性强弱,下列说法或实验能提供证据的是_______。
A.比较两种元素的单质的熔点、沸点高低
B.将两种元素的单质分别与冷水反应,观察反应的剧烈程度
C.比较两种元素的最高价氧化物对应的水化物的碱性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学常见的短周期主族元素R、X、Y、Z、M的原子序数依次增大,它们占据三个周期。Y和M位于同主族,Y原子最外层电子数是电子层数的3倍。这五种元素组成一种离子化合物Q,取一定量Q溶于蒸馏水得到溶液,向溶液中滴加稀氢氧化钠溶液,产生的沉定与氢氧化钠溶液体积的关系如图所示。下列说法不正确的是
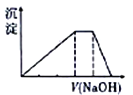
A. 气态氢化物的沸点:Y>X
B. R与除Z以外的其他3种元素均能形成共价化合物
C. 简单离子的半径:M>Y>Z
D. Y与其他4种元素均可形成至少两种二元化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)已知某反应中能量变化如图所示,所得结论错误的是( )
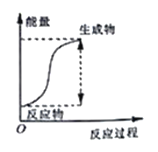
A. 该图像可以表示氯化铵与消石灰反应的能量变化
B. 该反应过程中,一定有其他形式的能量转化成化学能
C. 该反应过程中,形成新化学键释放的总能量小于断裂旧化学键吸收的总能量
D. 因为生成物的总能量高于反应物的总能量,所以该反应一定需要加热才可进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁及其化合物是实验设计的热点载体,查阅资料。
ⅰ | 2NO2+2NaOH=NaNO2+NaNO3+H2O |
ⅱ | Mg3N2与水反应 |
ⅲ | 常温下,NH3·H2O、CH3COOH的电离常数都等于1.8×10-5 |
Ⅰ.探究镁的性质。
某学习小组设计实验探究镁与二氧化氮反应的产物,实验装置如图所示。
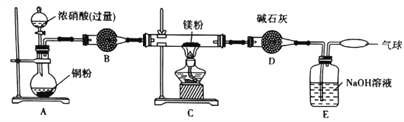
(1)B中试剂是_____________;D装置的作用是______________________________。
(2)实验时,先启动A中反应,当C装置中充满红棕色气体时点燃酒精灯,这样操作的目的是____________________________________________________________________________。
(3)确定有N2生成的实验现象是_______________________________________________________。
(4)实验完毕后,设计实验确认产物中有Mg3N2取少量C中残留固体于试管中,滴加蒸馏水,_____________________,则产物中有氮化镁。
(5)经测定,Mg与NO2反应生成MgO、Mg3N2和N2,其中Mg3N2和N2的物质的量相等。C中发生反应的化学方程式为_____________________________________________________。
Ⅱ.探究Mg(OH)2在氯化铵溶液中溶解的原因。供选试剂有:氢氧化镁、蒸馏水、硝酸氨溶液、盐酸、醋酸铵溶液。
取少量氢氧化镁粉末投入氯化氨溶液中,振荡、白色粉末全部溶解。为了探究其原因,他们提出两种假设。
假设1:氯化铵溶液呈酸性,H++OH-=H2O,促进Mg(OH)2溶解;
假设2:NH4++OH-=NH3·H2O,促进Mg(OH)2溶解。
(6)请你帮他们设计实验探究哪一种假设正确:____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com