
【题目】为探究金属的腐蚀情况,某同学将锌片和铜片置于浸有饱和食盐水和酚酞的滤纸上,并构成如图所示的装置。下列判断合理的是( )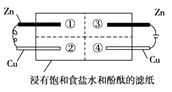
A.左边铜片上有气泡冒出
B.右边锌片上的反应为2Cl-- 2e-=Cl2↑
C.最先观察到红色的区域是②
D.两铜片质量均不发生变化
科目:高中化学 来源: 题型:
【题目】根据要求完成下列化学方程式或离子方程式。
(1)利用铝热反应焊接钢轨的化学方程式为_________________________。
(2)实验室利用二氧化锰和浓盐酸制取氧气的化学方程式为__________________。
(3)乙醇与金属钠反应的化学方程式为___________________________。
(4)苯与浓硫酸和浓硝酸混合液共热制取硝基苯的化学方程式为__________________。
(5)氯化铝溶液与氨水制备氢氧化铝的离子方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,下列热化学方程式书写正确的是( )
A.CH3OH(l)+ ![]() O2(g)=CO2(g)+2H2O(l) ΔH=+725.76 kJ·mol-1
O2(g)=CO2(g)+2H2O(l) ΔH=+725.76 kJ·mol-1
B.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1451.52 kJ·mol-1
C.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-725.76 kJ·mol-1
D.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=+1451.52 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用金属钴板(含少量Fe、Ni)制备应用广泛的氯化钴的工艺流程如下:
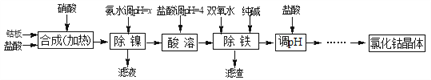
注:钴与盐酸反应极慢,需加入催化剂硝酸才可能进行实际生产。
有关钴、镍和铁化合物的性质见下表:
化学式 | 沉淀完全时的pH | 钴镍性质 |
Co(OH)2 | 9.4 | Co+2HCl=CoCl2+H2↑ Co2++2NH3·H2O=Co(OH)2↓+2NH4+ Co2++2H2O Ni+2HCl=NiCl2+H2↑ Ni2++6NH3·H2O=[Ni(NH3)6]2++6H2O |
Fe(OH)2 | 9.6 | |
Fe (OH)3 | 3.7 |
(1)“除镍”步骤中,NH3·H2O用量对反应收率的影响见表中数据:从表中数据可知,当PH调节至x=_______时,除镍效果最好。
加NH3·H2O调pH | 收率/% | Ni2+含量/% |
9 | 98.1 | 0.08 |
9.5 | 98 | 0.05 |
10 | 97.6 | 0.005 |
10.3 | 94 | 0.005 |
(2)“除镍”步骤必须控制在一定的时间内完成,否则沉淀中将有部分Co(OH)2转化为Co(OH)3,此反应的化学方程式为________________。
(3)“除铁”步骤中加入双氧水发生反应的离子方程式是________________________。
(4)“除铁”步骤中加入的纯碱作用是_______________________________。
(5)在“调pH”步骤中,加盐酸的作用是______________________________。
(6)已知25℃时,Ksp[Fe(OH)3]=4.0×10-38,则该温度下反应Fe3++3H2O![]() Fe(OH)3+3H+的平衡常数为_____________________。
Fe(OH)3+3H+的平衡常数为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.1molCu2(OH)2CO3后恰好恢复到电解前的浓度和pH(不考虑CO2的溶解)。则电解过程中共转移电子的物质的量为( )
A.0.4mol
B.0.5mol
C.0.6mol
D.0.8mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将一定量碳酸氢铵固体置于容积不变密闭容器中,发生反应:
NH4HCO3(s)![]() NH3(g)+H2O(g)+CO2(g) △H=QkJ/mol(Q>0)。下列有关说法不正确的是
NH3(g)+H2O(g)+CO2(g) △H=QkJ/mol(Q>0)。下列有关说法不正确的是
A. 若容器内混合气体的密度不变,则说明反应达到平街状态
B. 若CO2体积分数不再发生变化,则说明反应达到平街状态
C. 若升高体系温度,则正、逆反应速率均增大
D. 若反应过程中吸收QkJ热量,则刚好有lmol NH4HCO3发生分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2、CO、CH4、CH3OH等都是重要的能源,也是重要为化工原料。
(1)已知25℃,1.01×105Pa时,8.0g CH4完全燃烧生成二氧化碳气体和液态水放出444.8kJ热量。写出该反应的热化学反应方程式:___________________________________________。
(2)为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量及有效地开发利用CO2,工业上可以用CO2来生产燃料甲醇。在体积为2L的密闭容器中,充入lmol CO2和3mol H2,一定条件下发生反应:CO2(g) + 3H2(g) ![]() CH3OH(g) + H2O(g)。经测得CO2和CH3OH(g)的物质的量随时间变化如图所示。
CH3OH(g) + H2O(g)。经测得CO2和CH3OH(g)的物质的量随时间变化如图所示。
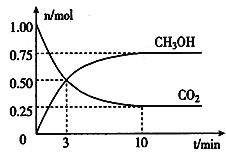
①从反应开始到平衡,CO2的平均反应速率v(CO2)=___________________。
②达到平衡时,H2的转化率为__________。
③该反应的平衡常数K=___________________(表达式)。
④下列措施不能提高反应速率的是__________。
A.升高温度 B.加入催化剂 C.增大压强 D.及时分离出CH3OH
(3)工业上也用CO和H2为原料制备CH3OH,反应方程式为:CO(g) + 2H2(g)![]() CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是______。
CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是______。
A.反应中CO与CH3OH的物质的量之比为1:1
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗1 mol CO,同时生成1 mol CH3OH
D.CH3OH的质量分数在混合气体中保持不变
E.混合气体的密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(ClNO)是有机合成中常用的试剂。
巳知:①2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g)△H1=akJ·mol-1
NaNO3(s)+ClNO(g)△H1=akJ·mol-1
②4NO2(8)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)△H2=bkJ·mol-1
2NaNO3(s)+2NO(g)+Cl2(g)△H2=bkJ·mol-1
③2NO(g)+Cl2(g)![]() 2ClNO(g)△H3=ckJ·mol-1
2ClNO(g)△H3=ckJ·mol-1
(1)上述反应中,a、b、c之间满足的关系为_____________________。
(2)某温度下,在密闭容器中发生反应:2NO(g)+Cl2(g)![]() 2ClNO(g),正反应速率表达式为v正=k·cn(NO)·cm(Cl2)(k是反应速率常数,只与温度有关;n、m为反应级数,只取正数)。测得正反应速率与浓度的关系如下表所示:
2ClNO(g),正反应速率表达式为v正=k·cn(NO)·cm(Cl2)(k是反应速率常数,只与温度有关;n、m为反应级数,只取正数)。测得正反应速率与浓度的关系如下表所示:
序号 | c(NO)/mol·L-1 | c(Cl2)/mol·L-1 | v正/mol·L-1·min-1 |
ⅰ | 0.100 | 0.100 | 0.144 |
ⅱ | 0.100 | 0.200 | 0.288 |
ⅲ | 0.200 | 0.100 | 0.576 |
①n=_____________,m=_____________。
②反应达到平衡后,其他条件不变时,缩小容器体积瞬间,v正_____________v逆(填“>"“<”或“=")。NO的平衡转化率_____________(填“增大”“减小”或“不变”)。
(3)在2L恒容密闭容器中充入0.8molClNO(g),发生反应:2ClNO(g)![]() Cl2(g)+2NO(g) △H,测得c(Cl2)与温度和时间的关系如图1所示。300℃时达到平衡后,温度与平衡常数负对数(-lgK)的关系如图2所示。
Cl2(g)+2NO(g) △H,测得c(Cl2)与温度和时间的关系如图1所示。300℃时达到平衡后,温度与平衡常数负对数(-lgK)的关系如图2所示。
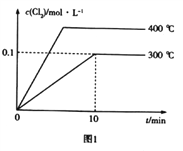
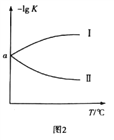
①a=_____________。
②图2中符合题意的曲线为_____________(填“Ⅰ”或“Ⅱ”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com