
【题目】在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,下列热化学方程式书写正确的是( )
A.CH3OH(l)+ ![]() O2(g)=CO2(g)+2H2O(l) ΔH=+725.76 kJ·mol-1
O2(g)=CO2(g)+2H2O(l) ΔH=+725.76 kJ·mol-1
B.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1451.52 kJ·mol-1
C.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-725.76 kJ·mol-1
D.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=+1451.52 kJ·mol-1
 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
【题目】某化学小组的同学为探究原电池原理,设计如图所示装置,将锌、铜通过导线相连,置于稀硫酸中。
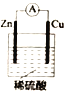
(1)锌片上的电极反应式为__________________。
(2)铜片上的现象是__________________。
(3)若反应过程中有0.2 mol电子发生转移,则生成的气体在标准状况下的体积为______________。
(4)该小组同学将稀硫酸分别换成下列试剂,电流计仍会偏转的是_________(填序号)。
A.无水乙醇 B.醋酸溶液 C.CuSO4溶液 D.苯
(5)实验后同学们经过充分讨论,认为符合某些要求的化学反应都可以通过原电池来实现。下列反应可以设计成原电池的是________(填字母代号)。
A. NaOH+HCl= NaCl+H2O B. 2H2+O2=2H2O
C. Fe+2FeCl3=3FeCl2 D. 2H2O=2H2↑+2O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图装置进行实验,开始时,a、b两处液面相平,密封好,放置一段时间。下列说法不正确的是 ( ) 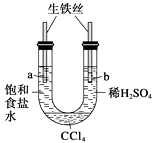
A.a管发生吸氧腐蚀,b管发生析氢腐蚀
B.一段时间后,a管液面高于b管液面
C.a处溶液的pH增大,b处溶液的pH减小
D.a、b两处具有相同的电极反应式:Fe-2e-= Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求对下图中两极进行必要的连接并填空: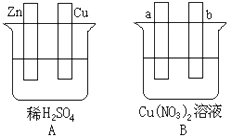
(1)在A图中,使铜片上冒气泡。请加以必要联接,则联接后的装置叫。电极反应式:锌电极:;铜电极:。
(2)在B图中(a,b都为惰性电极),使a极析出铜,则b析出:。加以必要的联接后,该装置叫。电极反应式: b极: 。经过一段时间后,停止反应并搅均溶液,溶液的pH值(升高、降低、不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图装置做铝热反应实验。下列说法不正确的是( )

A.该反应的方程式是2Al+Fe2O3 ![]() 2Fe+Al2O3
2Fe+Al2O3
B.该反应产生高温,发出强光
C.根据铝热反应原理,可以冶炼某些金属
D.若反应中转移3 mol电子,则消耗氧化剂的物质的量是1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在电解炼铝过程中加入冰晶石(用“A”代替),可起到降低Al2O3熔点的作用。冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO3=2A+3CO2↑+9H2O。根据题意完成下列填空:
(1)冰晶石的化学式为____________, 含有离子键、____________等化学键。
(2)生成物中含有10个电子的分子是________(写分子式),该分子的空间构型_______,中心原子的杂化方式为___________________。
(3)反应物中电负性最大的元素为________(填元素符号),写出其原子最外层的电子排布图:_______________。
(4)冰晶石由两种微粒构成,冰晶石的晶胞结构如图甲所示,●位于大立方体的顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处所代表的微粒是__________(填微粒符号)。
(5)Al单质的晶体中原子的堆积方式如图乙所示,其晶胞特征如图丙所示,原子之间相互位置关系的平面图如图丁所示:

若已知Al的原子半径为d,NA代表阿伏加德罗常数,Al的相对原子质量为M,则一个晶胞中Al原子的数目为___________个; Al晶体的密度为________(用字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:

(1)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为 ___________ .
(2)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达![]() ,有关反应的离子方程式为_________________;
,有关反应的离子方程式为_________________;
(3)从理论上考虑,下列物质也能吸收Br2的是____________.
A. H2O B. Na2CO3 C. Na2SO3 D. FeCl3
(4)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,![]() 的沸点为
的沸点为![]() ,微溶于水,有毒性和强腐蚀性。步骤Ⅲ的操作中对盛有工业溴的蒸馏烧瓶采取的加热方式是__________ ,溴蒸汽冷凝后得到液溴和溴水的混合物,可利用它们的相对密度相差较大的特点进行分离,所用的分离仪器名称是__________ .
,微溶于水,有毒性和强腐蚀性。步骤Ⅲ的操作中对盛有工业溴的蒸馏烧瓶采取的加热方式是__________ ,溴蒸汽冷凝后得到液溴和溴水的混合物,可利用它们的相对密度相差较大的特点进行分离,所用的分离仪器名称是__________ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究金属的腐蚀情况,某同学将锌片和铜片置于浸有饱和食盐水和酚酞的滤纸上,并构成如图所示的装置。下列判断合理的是( )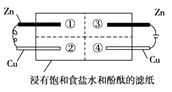
A.左边铜片上有气泡冒出
B.右边锌片上的反应为2Cl-- 2e-=Cl2↑
C.最先观察到红色的区域是②
D.两铜片质量均不发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物M由两种常见的元素组成,为了测定其组成进行如下实验:
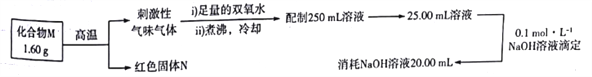
M的化学式可能为( )
A. Cu2S B. CuS C. FeS2 D. Fe3S4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com