
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:

(1)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为 ___________ .
(2)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达![]() ,有关反应的离子方程式为_________________;
,有关反应的离子方程式为_________________;
(3)从理论上考虑,下列物质也能吸收Br2的是____________.
A. H2O B. Na2CO3 C. Na2SO3 D. FeCl3
(4)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,![]() 的沸点为
的沸点为![]() ,微溶于水,有毒性和强腐蚀性。步骤Ⅲ的操作中对盛有工业溴的蒸馏烧瓶采取的加热方式是__________ ,溴蒸汽冷凝后得到液溴和溴水的混合物,可利用它们的相对密度相差较大的特点进行分离,所用的分离仪器名称是__________ .
,微溶于水,有毒性和强腐蚀性。步骤Ⅲ的操作中对盛有工业溴的蒸馏烧瓶采取的加热方式是__________ ,溴蒸汽冷凝后得到液溴和溴水的混合物,可利用它们的相对密度相差较大的特点进行分离,所用的分离仪器名称是__________ .
【答案】 富集溴元素 SO2+Br2+2H2O=4H++SO42+2Br BC 水浴加热 分液漏斗
【解析】通过海水蒸发得到淡水、NaCl、母液,向母液中通入氯气,发生反应Cl2+2Br-=2Cl-+Br2,利用热空气吹出溴,用SO2吸收Br2,发生反应SO2+Br2+2H2O=H2SO4+2HBr,向溶液中通入氯气发生反应Cl2+2Br-=2Cl-+Br2,然后采用萃取的方法获取Br2。
(1)海水中溴元素含量较少,步骤I中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为富集溴元素,故答案为:富集溴元素;
(2)在水溶液里溴和二氧化硫反应离子方程式为SO2+Br2+2H2O=4H++SO42-+2Br-,由此反应可知,生成物为强酸,所以除环境保护外,在工业生产中应解决的主要问题是强酸对设备的严重腐蚀,故答案为:SO2+Br2+2H2O=4H++SO42-+2Br-;
(3)A.H2O和溴单质反应微弱,不能充分吸收溴单质,故A错误;B.碳酸钠溶液显碱性,溴的水溶液显酸性,碱性溶液可以与酸性溶液反应,可以吸收,故B正确;C.Na2SO3 溶液具有还原性,可以被溴单质氧化,能吸收溴单质,故C正确;D.FeCl3溶液具有氧化性,不能氧化溴单质,因此不能吸收溴单质,故D错误;故答案为:BC;
(4)![]() 的沸点为
的沸点为![]() ,微溶于水,有毒性和强腐蚀性,步骤Ⅲ的操作中对盛有工业溴的蒸馏烧瓶采取的加热方式可以是水浴加热,溴蒸汽冷凝后得到液溴密度比水大,沉在溴水的下面,可以通过分液的方法分离,使用的仪器为分液漏斗,故答案为:水浴加热;分液漏斗。
,微溶于水,有毒性和强腐蚀性,步骤Ⅲ的操作中对盛有工业溴的蒸馏烧瓶采取的加热方式可以是水浴加热,溴蒸汽冷凝后得到液溴密度比水大,沉在溴水的下面,可以通过分液的方法分离,使用的仪器为分液漏斗,故答案为:水浴加热;分液漏斗。


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:
【题目】按如图所示装置进行实验,以制取乙酸乙酯。
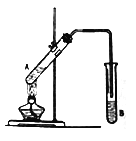
(1)试管A中的液体由以下试剂混合而成:①2mL乙醇;②3mL浓硫酸;③2mL 乙酸。一般况下,这三种试剂的加入顺序是:先加入________(填序号,下同),再加入_________,最后加入③。
(2)为防止试管A中的液体在实验时发生暴沸,在加热前还应加入碎瓷片。若加热后发现未加入碎瓷片,应采取的补救措施是:_________________________________________________________。
(3)试管B中盛放的试剂是___________________;反应结束后,分离B中的液体混合物需要用到的玻璃仪器主要是_____________。试管B中的导管末端不伸入液面下方的目的是_______________。
(4)试管 A中CH3COOH与C2H518OH反应的化学方程式为:___________________________________。
(5)该实验中用30gCH3COOH与46gC2H5OH反应,如果实际得到的乙酸乙酯的质量是26.4g,该实验中乙酸乙酯的产率是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是
A. 分子式为C3H6Cl2的有机物有4种同分异构体(不考虑立体异构)
B. ![]() 和
和![]() 互为同系物
互为同系物
C. 乙炔和溴的四氯化碳溶液反应生成1,2-二溴乙烷
D. 甲苯分子中所有原子都在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,下列热化学方程式书写正确的是( )
A.CH3OH(l)+ ![]() O2(g)=CO2(g)+2H2O(l) ΔH=+725.76 kJ·mol-1
O2(g)=CO2(g)+2H2O(l) ΔH=+725.76 kJ·mol-1
B.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1451.52 kJ·mol-1
C.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-725.76 kJ·mol-1
D.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=+1451.52 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 任何晶体中,若含有阳离子,就一定含有阴离子
B. 金属晶体的形成是因为晶体中存在金属离子间的相互作用
C. 价电子越多的金属原子的金属性越强
D. 含有金属元素的离子不一定是阳离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用金属钴板(含少量Fe、Ni)制备应用广泛的氯化钴的工艺流程如下:
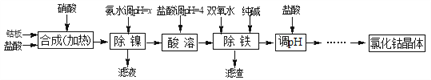
注:钴与盐酸反应极慢,需加入催化剂硝酸才可能进行实际生产。
有关钴、镍和铁化合物的性质见下表:
化学式 | 沉淀完全时的pH | 钴镍性质 |
Co(OH)2 | 9.4 | Co+2HCl=CoCl2+H2↑ Co2++2NH3·H2O=Co(OH)2↓+2NH4+ Co2++2H2O Ni+2HCl=NiCl2+H2↑ Ni2++6NH3·H2O=[Ni(NH3)6]2++6H2O |
Fe(OH)2 | 9.6 | |
Fe (OH)3 | 3.7 |
(1)“除镍”步骤中,NH3·H2O用量对反应收率的影响见表中数据:从表中数据可知,当PH调节至x=_______时,除镍效果最好。
加NH3·H2O调pH | 收率/% | Ni2+含量/% |
9 | 98.1 | 0.08 |
9.5 | 98 | 0.05 |
10 | 97.6 | 0.005 |
10.3 | 94 | 0.005 |
(2)“除镍”步骤必须控制在一定的时间内完成,否则沉淀中将有部分Co(OH)2转化为Co(OH)3,此反应的化学方程式为________________。
(3)“除铁”步骤中加入双氧水发生反应的离子方程式是________________________。
(4)“除铁”步骤中加入的纯碱作用是_______________________________。
(5)在“调pH”步骤中,加盐酸的作用是______________________________。
(6)已知25℃时,Ksp[Fe(OH)3]=4.0×10-38,则该温度下反应Fe3++3H2O![]() Fe(OH)3+3H+的平衡常数为_____________________。
Fe(OH)3+3H+的平衡常数为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.1molCu2(OH)2CO3后恰好恢复到电解前的浓度和pH(不考虑CO2的溶解)。则电解过程中共转移电子的物质的量为( )
A.0.4mol
B.0.5mol
C.0.6mol
D.0.8mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2、CO、CH4、CH3OH等都是重要的能源,也是重要为化工原料。
(1)已知25℃,1.01×105Pa时,8.0g CH4完全燃烧生成二氧化碳气体和液态水放出444.8kJ热量。写出该反应的热化学反应方程式:___________________________________________。
(2)为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量及有效地开发利用CO2,工业上可以用CO2来生产燃料甲醇。在体积为2L的密闭容器中,充入lmol CO2和3mol H2,一定条件下发生反应:CO2(g) + 3H2(g) ![]() CH3OH(g) + H2O(g)。经测得CO2和CH3OH(g)的物质的量随时间变化如图所示。
CH3OH(g) + H2O(g)。经测得CO2和CH3OH(g)的物质的量随时间变化如图所示。
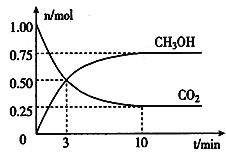
①从反应开始到平衡,CO2的平均反应速率v(CO2)=___________________。
②达到平衡时,H2的转化率为__________。
③该反应的平衡常数K=___________________(表达式)。
④下列措施不能提高反应速率的是__________。
A.升高温度 B.加入催化剂 C.增大压强 D.及时分离出CH3OH
(3)工业上也用CO和H2为原料制备CH3OH,反应方程式为:CO(g) + 2H2(g)![]() CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是______。
CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是______。
A.反应中CO与CH3OH的物质的量之比为1:1
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗1 mol CO,同时生成1 mol CH3OH
D.CH3OH的质量分数在混合气体中保持不变
E.混合气体的密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组设计实验探究H2S的性质,装置如图所示。

下列说法正确的是( )
A. 若F中产生黑色沉淀,则说明H2SO4的酸性比H2S强
B. 若G中产生浅黄色沉淀,则说明H2S的还原性比Fe2+强
C. 若H中溶液变红色,则说明H2S是二元弱酸
D. 若E中FeS换成Na2S,该装置也可达到相同的目的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com