
����Ŀ��ij��ѧС���ͬѧΪ̽��ԭ���ԭ���������ͼ��ʾװ�ã���п��ͭͨ����������������ϡ�����С�
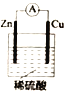
��1��пƬ�ϵĵ缫��ӦʽΪ__________________��
��2��ͭƬ�ϵ�������__________________��
��3������Ӧ��������0.2 mol���ӷ���ת�ƣ������ɵ������ڱ�״���µ����Ϊ______________��
��4����С��ͬѧ��ϡ����ֱ������Լ����������Ի�ƫת����_________������ţ���
A����ˮ�Ҵ� B��������Һ C��CuSO4��Һ D����
��5��ʵ���ͬѧ�Ǿ���������ۣ���Ϊ����ijЩҪ��Ļ�ѧ��Ӧ������ͨ��ԭ�����ʵ�֡����з�Ӧ������Ƴ�ԭ��ص���________������ĸ���ţ���
A�� NaOH+HCl= NaCl+H2O B�� 2H2+O2=2H2O
C�� Fe+2FeCl3=3FeCl2 D�� 2H2O=2H2��+2O2��
���𰸡� Zn-2e-��Zn2+ �������� 2.24 L BC BC
��������п��ͭ��ϡ���ṹ��ԭ��أ�п��������ͭ����������1������ʧ���ӷ���������Ӧ���缫��ӦʽΪ��Zn-2e-��Zn2+����2���������������õ���������������ͭƬ�ϲ�����������3������2H++2e-=H2������0.2 mol���ӷ���ת�ƣ�������0.1mol H2���ڱ�״���µ����Ϊ2.24 L����4����ˮ�Ҵ��ͱ����ǵ������Һ���滻ϡ��������γ�ԭ��أ������Ʋ���ƫת��������Һ��CuSO4��Һ�ǵ������Һ���滻ϡ���������γ�ԭ��أ��������Ի�ƫת����ѡBC����5���Է���������ԭ��Ӧ������Ƴ�ԭ��أ�A���������ԭ��Ӧ��D����Է����У�B��C���Է���������ԭ��Ӧ����ѡBC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Fe(OH)2���ױ�����������ʵ����������������Һ���ռӦ�Ƶð�ɫ������Fe(OH)2��������������ͼ��ʾʵ��װ�ÿ��Ƶô�����Fe(OH)2�������������Ϸֱ���Ϊʯī������

������������⣺
(1)a�缫������_____���������Һd��Ϊ______(����ĸ)�����ɫ�����ڵ缫�����ɣ���ʱa�缫�ĵ缫��ӦʽΪ_________________________���������Һd��Ϊ____(����ĸ)�����ɫ����������֮�����Һ�����ɣ�����������£���·����0.4mol����ͨ����������������Fe(OH)2������Ϊ_______g��
A����ˮ���� B��NaCl��Һ C��NaOH��Һ D��CuCl2��Һ
(2)Һ��cΪ���������������__________________________���ڼ��뱽֮ǰ����d��Һ���м��ȴ�����Ŀ����__________________��
(3)��d��ΪNa2SO4��Һ�������һ��ʱ�䣬������ɫ�������ٷ��ӵ�Դ��������⣬���˵缫�Ͽ��������⣬��һ��������Ϊ________��������Ӧ�ķ���ʽΪ__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ʾװ��(������Ϊ���Ե缫)������SO2�����������ų�����Һ����NO2�����й��ڸ�װ��������˵������ȷ�������

��.aΪֱ����Դ�ĸ���
��.�����ĵ缫��ӦʽΪ��2HSO3-+2H++2e-=S2O42-+2H2O
��.�����ĵ缫��ӦʽΪ��SO2+2H2O-2e-=SO42-+4H+
��.���ʱ��H+��������ͨ�������ӽ���Ĥ��������
A. ������ B. ������
C. �ں͢� D. �ۺ͢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���ʵ�����Ʊ��������������ᶡ����������ȷ����
A. ������ˮԡ���� B. �����ñ߷�Ӧ������ķ���
C. �Ʊ���������ʱ�Ҵ����� D. �Ʊ����ᶡ��ʱ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�������������;�Ĺ�ϵ����ȷ����( )
A. �������ƣ������� B. �ռ ����θ������һ��ҩ��
C. С�մ� ���ͷ���Ҫ�ɷ� D. ������ ��ˮ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ڵ�Ԫ�ص��ʼ��仯�����й㷺����;����������֪ʶ�ش�����������
(1)ԭ�������������Ǻ����������![]() ��Ԫ�أ���ԭ�ӽṹʾ��ͼΪ________________����ԭ����������������__________ (�����ӷ��ţ���
��Ԫ�أ���ԭ�ӽṹʾ��ͼΪ________________����ԭ����������������__________ (�����ӷ��ţ���
(2)�����(�۵�1410��)�����õİ�������������ͨ����ͼ��ʾ�����Ʊ���
![]()
��������SiCl4�ƴ���ķ�Ӧ���� ����ÿ����2.8kg������Ҫ����akJ��������д���÷�Ӧ������ѧ����ʽ___________________��
(3)�Ȼ�����ˮ��Һ�����ھ�ˮ����ԭ����_________ (����������ʽ��ʾ)��
��ҵ����������(��Ҫ�ɷ�ΪAl2O3������Fe2O3��SiO2������)����ȡ��ˮ��������һ�ֹ���������ͼ��ʾ��
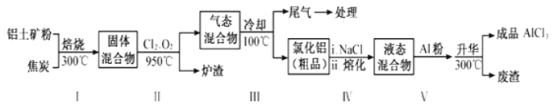
��֪��
���� | SiCl4 | AlCl3 | FeCl3 | FeCl2 | Al2O3 | Fe2O3 | SiO2 |
�е�/�� | 57.6 | 180(����) | 300(����) | 1023 | 2980 | 3414 | 2230 |
�ٹ�ҵ����ʱ�����Al2O3�������AlCl3��������____________��
�� ������б���ʹ����ˮ�ֻӷ���������Ŀ������ ��������_________ (ֻҪ��д��һ��)��
�۲����������ͨ�����������������������ԭ�������ȹ�������______________��
��β������ȴ�����º���������KOHŨ��Һ���������ɵ����г���K2CO3��������3��������ѧʽ�ֱ�Ϊ________________������һ����������ʵ������O2��������������400��ʱ�ֽ�ֻ���������Σ�����һ���������ᣬ��һ��������������������Ϊ1:1��д������Ӧ�Ļ�ѧ����ʽ��________________��
�ݽ��������������ݷ���������V�м������۵�Ŀ����__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���߾���M�������õ���ˮ�ԣ�������Ӥ������ʪ������Ҫ�ɷ�֮һ���ֲ�ȡ��ͼ��ʾ·�߿��Ժϳ�M��
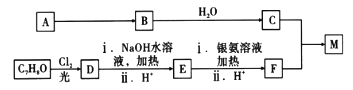
��֪����A�ڱ�״���£��ܶ�Ϊ1.16g/L��B��C��M��Ϊ�߾��
��F�ĺ˴Ź�������������壬���֮��Ϊ1:1:2:2����D���Ȼ�����Һ����ɫ��
��![]()
��ش��������⣺
(1)C7H8O��ʾ���ʵ�����Ϊ_________��D�ķ���ʽΪ___________��E��F�ķ�Ӧ����Ϊ___________.
(2)д��D��NaOHˮ��Һ��Ӧ�Ļ�ѧ����ʽ��________________��
(3)д��C+F ��M�Ļ�ѧ����ʽ��_________��
(4)NΪF��ͬϵ�����Է���������F�Ĵ�14�����жϷ�������������N��ͬ���칹��W��________�֣�д����������һ�ֵĽṹ��ʽ��___________________��
����NaHCO3��Һ��ϲ������壻��1mol W �������1mol NaOH����1mol W������Na��Ӧ����1mol H2��
(5)�Լױ�Ϊԭ�Ͽɺϳ�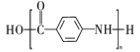 ������ƺϳ�·��ͼ________����֪��
������ƺϳ�·��ͼ________����֪��![]() ���������н�ǿ�Ļ�ԭ�ԣ��ױ�������ע�����Լ����ܼ���ѡ����
���������н�ǿ�Ļ�ԭ�ԣ��ױ�������ע�����Լ����ܼ���ѡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˱�����Ȼ�������������������������������Ӵ�������ɫ��Ⱦ����������ɫ��Ⱦ��ָ���ǣ� ��
A. ұ�����İ�ɫ�̳�B. ʯ��Ҥ�İ�ɫ��ĩ
C. ������ϩ����������D. ��ɫ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Һ�ĵ絼��Խ��������Խǿ���� 0.100 mol��L��1 �� NaOH ��Һ�ζ� 10.00 mL Ũ�Ⱦ�Ϊ 0.100 mol��L��1 ������� CH3COOH ��Һ�����ô�������õζ���������Һ�ĵ絼 ����ͼ��ʾ������˵����ȷ����( )

A. ���ߢٴ����ζ� HCl ��Һ������
B. A ����Һ�У�c(CH3COO��)��c(OH��)��c(H��)��0.1 mol��L��1
C. ����ͬ�¶��£�A��B��C ������Һ��ˮ�ĵ���̶ȣ�C��B=A
D. D ����Һ�У�c(Cl��)��2c(OH��)��2c(H��)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com