
【题目】下列各组物质与其用途的关系不正确的是( )
A. 过氧化钠:供氧剂 B. 烧碱: 治疗胃酸过多的一种药剂
C. 小苏打: 发酵粉主要成分 D. 明矾: 净水剂
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】I.过氧化钡常温下缓慢分解,不溶于水,常用作氧化剂、漂白剂等。请回答下列问题:
(1)BaO2的电子式为 __________________。
(2)BaCl2在氨水中与H2O2反应可得到BaO2沉淀,用一个离子反应方程式表示该原理为__________________________________________。
(3)配平下列反应方程式: (____)MnO4- + ( ) BaO2+= ( ) Ba2++ ( ) Mn2++ ( ) O2+ ( ) H2O
II、化合物甲由三种元素组成,某研究性学习小组按如下流程探究其组成:

已知:气体A能使品红溶液褪色,加热后品红溶液恢复至原色。取少量溶液B,滴加KSCN溶液,发现溶液变为血红色。请推测并回答:
(4)用离子反应方程式解释溶液变为血红色的原因:____________________________。
(5)写出形成溶液C的化学方程式:________________________________________。
(6)写出气体A通入溶液B中,发生氧化还原的离子反应方程式:_______________________。
(7)写出化合物甲的化学式______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,某容积为2L的密闭容器内,某一反应中M(g)、N(g)的物质的量随反应时间变化的曲线如图,依图所示:
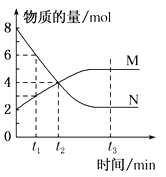
(1)该图形所描述的反应的化学方程式是______________。
(2)在图上所示的三个时刻中,_______(填t1、t2或t3)时刻处于平衡状态,此时v正____v逆(填>、<或=)。
(3)下列描述中能说明上述反应达到平衡状态的是_______。
A.容器中M与N的物质的量之比为1:l
B.混合气体的密度不随时间的变化而变化
C.混合气体的总物质的量不随时间的变化而变化
D.单位时间内消耗2molN的同时生成ImolM
(4)下列措施能增大反应速率的是_______(选填字母)
A.升高温度 B.降低压强 C.减小M的浓度 D.将反应容器体积缩小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标况下,将一装满NO2气体的试管倒置在水槽中,可见试管中液面逐渐上升,反应结束后,试管中所得溶液的物质的量浓度为(忽略溶质的扩散)( )
A. 1 mol/L B. 22.4 mol/L C. 0.045 mol/L D. 0.03 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钙是一种阻锈剂,可用于染料工业,某兴趣小组拟制备Ca(NO2)2并对其性质进行探究。
【背景素材】
I.NO+NO2+Ca(OH)2=Ca(NO2)2+H2O。
Ⅱ.Ca(NO2)2能被酸性KMnO4溶液氧化成NO3-,MnO4-被还原为Mn2+。
Ⅲ.在酸性条件下,Ca(NO2)2能将I-氧化为I2,S2O32-能将I2还原为I-。
【制备氮氧化物】
(1)甲组同学拟利用如下左图所示装置制备氮氧化物。

①仪器X、Y的名称分别是______________、______________。
②装置B中逸出的NO与NO2的物质的量之比为1∶1,则装置B中发生反应的化学方程式为_____________________ ,若其他条件不变,增大硝酸的浓度,则会使逸出的气体中n(NO2)__________n(NO)(填“>”或“<”)。
【制备Ca(NO2)2】
⑵乙组同学拟利用装置B中产生的氮氧化物制备Ca(NO2)2,装置如上右图。
①装置C中导管末端接一玻璃球的作用是________________。
②装置D的作用是______________;装置E的作用是________________。
【测定Ca(NO2)2的纯度】
⑶丙组同学拟测定Ca(NO2)2的纯度(杂质不参加反应),可供选择的试剂:
a.稀硫酸 b. c1mol·L-1的KI溶液 c.淀粉溶液
d.c2mol·L-1的Na2S2O3溶液 e.c3mol·L-1 的酸性 KMnO4 溶液
①利用Ca(NO2)2的还原性来测定其纯度,可选择的试剂是______________(填字母)。
②利用Ca(NO2)2的氧化性来测定其纯度的步骤:准确称取mgCa(NO2)2样品放入锥形瓶中,加适量水溶解,__________________(请补充完整实验步骤)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组的同学为探究原电池原理,设计如图所示装置,将锌、铜通过导线相连,置于稀硫酸中。
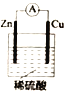
(1)锌片上的电极反应式为__________________。
(2)铜片上的现象是__________________。
(3)若反应过程中有0.2 mol电子发生转移,则生成的气体在标准状况下的体积为______________。
(4)该小组同学将稀硫酸分别换成下列试剂,电流计仍会偏转的是_________(填序号)。
A.无水乙醇 B.醋酸溶液 C.CuSO4溶液 D.苯
(5)实验后同学们经过充分讨论,认为符合某些要求的化学反应都可以通过原电池来实现。下列反应可以设计成原电池的是________(填字母代号)。
A. NaOH+HCl= NaCl+H2O B. 2H2+O2=2H2O
C. Fe+2FeCl3=3FeCl2 D. 2H2O=2H2↑+2O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式或电离方程式的书写正确的是()
A. NaHSO4熔融:NaHSO4=Na++HSO4-
B. Al(OH)3酸式电离: Al(OH)3= H++AlO2- + H2O
C. 向Na2S溶液中滴入少量稀盐酸:S 2-+2H+=H2S↑
D. Ca(HCO3)2溶液与过量NaOH溶液反应:OH-+HCO![]() +Ca2+=CaCO3↓+H2O
+Ca2+=CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 1mol乙酸(忽略挥发损失)与足量的C2H518OH在浓硫酸作用下加热,充分反应可生成NA个CH3CO18OC2H5分子
B. 6.4g O2和O3的混合气体,含氧原子数为0.4NA
C. 44g二氧化碳气体中含有共用电子对数目为2NA
D. 500mLO.5mol/L盐酸与0.435g MnO2共热后,生成Cl2分子的数目为0.005NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com