
【题目】标况下,将一装满NO2气体的试管倒置在水槽中,可见试管中液面逐渐上升,反应结束后,试管中所得溶液的物质的量浓度为(忽略溶质的扩散)( )
A. 1 mol/L B. 22.4 mol/L C. 0.045 mol/L D. 0.03 mol/L
科目:高中化学 来源: 题型:
【题目】一定量的混合气体在密闭容器中发生如下反应:mA(g)+nB(g)![]() pC(g)+qD(g),达到平衡后,温度不变,将气体体积缩小到原来的一半,当达到新平衡时,C的浓度由0.15 mol·L-1变为原来的0.20mol·L-1,则下列叙述正确的是
pC(g)+qD(g),达到平衡后,温度不变,将气体体积缩小到原来的一半,当达到新平衡时,C的浓度由0.15 mol·L-1变为原来的0.20mol·L-1,则下列叙述正确的是
A. m+n>p+q B. m+n<p+q
C. 平衡向正反应方向移动 D. C的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备1,2-二溴乙烷的原理:
CH3CH2OH![]() CH2=CH2↑+H2O
CH2=CH2↑+H2O
CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示,有关数据列表如下:
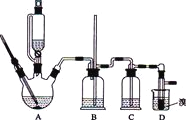
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/gcm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
(1)在反应中若加热后发现未加沸石,应采取的正确方法是________________;判断该制备反应已经结束的最简单方法是_________________。
(2)装置C中应加入______________,吸收反应中产生的某些有影响的杂质气体(填写正确选项前的字母)
a.水 b.浓硫酸 c.NaOH溶液 d.KMnO4溶液
(3)装置B中竖直的长导管起安全管的作用,其原理是_____________。
(4)若产物中有少量Br2,最好用_________洗涤除去(填写正确选项前的字母)
a.水 b.乙醇 c.KI溶液 d.NaHSO3溶液
发生反应的化学方程为____________________。
(5)若产物中有少量副产物乙醚,可用__________的方法除去。
(6)反应过程中应用冷水冷却装置D,主要目的是__________________,但又不能过度冷却(如用冰水),其原因是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2。下列关于该装置的四种说法,正确的组合是

①.a为直流电源的负极
②.阴极的电极反应式为:2HSO3-+2H++2e-=S2O42-+2H2O
③.阳极的电极反应式为:SO2+2H2O-2e-=SO42-+4H+
④.电解时,H+由阴极室通过阳离子交换膜到阳极室
A. ①和② B. ①和③
C. ②和③ D. ③和④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我们利用物质的结构与性质对周期表进行研究,有助于我们更好地掌握同类知识。
(1)基态砷原子中,价电子占用_________个原子轨道;雌黄分子式为As2S3,分子结构如图,则As原子的杂化方式为_________ 。

(2)N2与CO互为等电子体,则1molCO分子中含有的π键数目是_________个。
(3)向CuSO4溶液中加人少量氨水生成蓝色沉淀,继续加人过量氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加人一定量乙醇,析出[Cu(NH3)4]SO4 .H2O晶体;该晶体所含的非金厲元素中,N、O、S第一电离能由大到小的顺序是_________ (填元素符号),SO42-的空间构型为____________,晶体中含有的化学键有__________。加人乙醇后析出[Cu(NH3)4]SO4 .H2O晶体的原因是____________。
(4)常温下PCl5是一种白色晶体,其立方晶系晶体结构模型如下左图所示,由A、B两种微粒构成。 将其加热至148℃熔化,形成一种能导电的熔体。已知A微粒与CCl4具有相同的空间构型和相似的化学键特征,则A为_________ , B为_______________。
(5)磷化硼(BP)是一种超硬耐磨涂层材料,下右图为其立方晶胞。已知晶体中最近的硼原子和磷原子核间距为x cm,磷化硼的摩尔质量为bg.·mol-1,阿伏加德罗常数为NA,则磷化硼晶体密度的表达式
为____________g.cm-3。(列出计算式即可)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于实验室制备乙酸乙酯和乙酸丁酯的描述正确的是
A. 均采用水浴加热 B. 均采用边反应边蒸馏的方法
C. 制备乙酸乙酯时乙醇过量 D. 制备乙酸丁酯时正丁醇过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质与其用途的关系不正确的是( )
A. 过氧化钠:供氧剂 B. 烧碱: 治疗胃酸过多的一种药剂
C. 小苏打: 发酵粉主要成分 D. 明矾: 净水剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高聚物M具有良好的吸水性,是制造婴儿“尿不湿”的主要成分之一,现采取如图所示路线可以合成M。
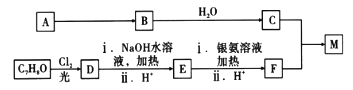
已知:①A在标准状况下,密度为1.16g/L,B、C、M均为高聚物;
②F的核磁共振氢谱有四组峰,面积之比为1:1:2:2;且D遇氯化铁溶液显紫色;
③![]()
请回答下列问题:
(1)C7H8O表示物质的名称为_________,D的分子式为___________,E→F的反应类型为___________.
(2)写出D与NaOH水溶液反应的化学方程式:________________。
(3)写出C+F →M的化学方程式:_________。
(4)N为F的同系物,且相对分子质量比F的大14。请判断符合下列条件的N的同分异构体W有________种,写出其中任意一种的结构简式:___________________。
①与NaHCO3溶液混合产生气体;②1mol W 最多消耗1mol NaOH;③1mol W与足量Na反应产生1mol H2。
(5)以甲苯为原料可合成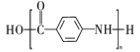 ,请设计合成路线图________(已知:
,请设计合成路线图________(已知:![]() ,氨基具有较强的还原性,易被氧化;注:无机试剂及溶剂任选)。
,氨基具有较强的还原性,易被氧化;注:无机试剂及溶剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 光导纤维的主要成分为二氧化硅 B. SiO2是酸性氧化物,它不溶于任何酸
C. SiO2的俗名叫水玻璃,不溶于水 D. Si在自然界中既有游离态又有化合态
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com