
【题目】实验室制备1,2-二溴乙烷的原理:
CH3CH2OH![]() CH2=CH2↑+H2O
CH2=CH2↑+H2O
CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示,有关数据列表如下:
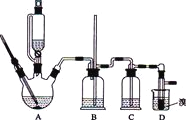
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/gcm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
(1)在反应中若加热后发现未加沸石,应采取的正确方法是________________;判断该制备反应已经结束的最简单方法是_________________。
(2)装置C中应加入______________,吸收反应中产生的某些有影响的杂质气体(填写正确选项前的字母)
a.水 b.浓硫酸 c.NaOH溶液 d.KMnO4溶液
(3)装置B中竖直的长导管起安全管的作用,其原理是_____________。
(4)若产物中有少量Br2,最好用_________洗涤除去(填写正确选项前的字母)
a.水 b.乙醇 c.KI溶液 d.NaHSO3溶液
发生反应的化学方程为____________________。
(5)若产物中有少量副产物乙醚,可用__________的方法除去。
(6)反应过程中应用冷水冷却装置D,主要目的是__________________,但又不能过度冷却(如用冰水),其原因是_________________。
【答案】 冷却后补加 溴的颜色已完全褪色 c 当B中的压强过大时,安全管中液面上升,从而调节B中气压相对稳定。 d NaHSO3+Br2+H2O=NaHSO4+2HBr 蒸馏 乙烯与溴水反应放热,冷却可避免溴的大量挥发 1,2-二溴乙烷的熔点为9℃,过度冷却会使凝固而使气路堵塞。
【解析】实验室制备1,2-二溴乙烷的反应原理为:A装置中乙醇发生消去反应生成乙烯:CH3CH2OH![]() CH2=CH2↑+H2O,B装置可以作安全瓶,要以防倒吸,由于有副反应的发生,生成的乙烯中有酸性气体,所以C装置用氢氧化钠吸收乙烯中的酸性杂质气体,然后乙烯与溴发生加成反应生成1,2-二溴乙烷:CH2=CH2+Br2→BrCH2CH2Br,产物中混有的溴单质可以用氢氧化钠溶液除去。
CH2=CH2↑+H2O,B装置可以作安全瓶,要以防倒吸,由于有副反应的发生,生成的乙烯中有酸性气体,所以C装置用氢氧化钠吸收乙烯中的酸性杂质气体,然后乙烯与溴发生加成反应生成1,2-二溴乙烷:CH2=CH2+Br2→BrCH2CH2Br,产物中混有的溴单质可以用氢氧化钠溶液除去。
(1)在反应中若加热后发现未加沸石,应冷却后补加;乙烯和溴水发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷为无色,因此判断该制备反应已经结束的最简单方法是溴的颜色已完全褪色,故答案为:冷却后补加 ; 溴的颜色已完全褪色;
(2)浓硫酸具有强氧化性,将乙醇氧化成二氧化碳,自身被还原成二氧化硫,二氧化碳、二氧化硫能和氢氧化钠溶液反应,故答案为:c;
(3)1,2-二溴乙烷熔点为9℃,冷却容易析出晶体,堵塞玻璃导管,B为安全瓶,可以防止倒吸,根据B中长导管内外液面高低变化,可以判断是否发生堵塞,当B中的压强过大时,安全管中液面上升,从而调节B中气压相对稳定,故答案为:当B中的压强过大时,安全管中液面上升,从而调节B中气压相对稳定;
(4)a.溴在水中的溶解度不是很大,故不选;b. 1,2-二溴乙烷易溶于乙醇,故不选;c.溴与KI溶液反应后会引入新杂质碘,故不选;d.溴与NaHSO3溶液溶液发生氧化还原反应,生成易溶于水的盐,容易与1,2-二溴乙烷分层除去,发生反应的化学方程为NaHSO3+Br2+H2O=NaHSO4+2HBr,故选;故答案为:d;NaHSO3+Br2+H2O=NaHSO4+2HBr;
(5) 1,2-二溴乙烷和乙醚互溶,但沸点相差较大,可以通过蒸馏除去乙醚,故答案为:蒸馏;
(6)溴在常温下,易挥发,乙烯与溴反应时放热,溴更易挥发,冷却可避免溴的大量挥发,但1,2-二溴乙烷的凝固点9℃较低,不能过度冷却,故答案为:乙烯与溴反应时放热,冷却可避免溴的大量挥发;1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞。


科目:高中化学 来源: 题型:
【题目】已知:①Zn(s)+![]() O2(g)=ZnO(s)ΔH=-348.3kJ·mol-1
O2(g)=ZnO(s)ΔH=-348.3kJ·mol-1
②2Ag(s)+![]() O2(g)=Ag2O(s)ΔH=-31.0kJ·mol-1
O2(g)=Ag2O(s)ΔH=-31.0kJ·mol-1
则Zn与Ag2O反应生成ZnO和Ag的热化学方程式为
A. Zn(s)+Ag2O(s)===ZnO(s)+2Ag(s)ΔH=+317.3kJ·mol-1
B. Zn+Ag2O===ZnO+2Ag ΔH=+317.3kJ·mol-1
C. Zn(s)+Ag2O(s)===ZnO(s)+2Ag(s)ΔH=-317.3kJ
D. 2Zn(s)+2Ag2O(s)===2ZnO(s)+4Ag(s)ΔH=-634.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.过氧化钡常温下缓慢分解,不溶于水,常用作氧化剂、漂白剂等。请回答下列问题:
(1)BaO2的电子式为 __________________。
(2)BaCl2在氨水中与H2O2反应可得到BaO2沉淀,用一个离子反应方程式表示该原理为__________________________________________。
(3)配平下列反应方程式: (____)MnO4- + ( ) BaO2+= ( ) Ba2++ ( ) Mn2++ ( ) O2+ ( ) H2O
II、化合物甲由三种元素组成,某研究性学习小组按如下流程探究其组成:

已知:气体A能使品红溶液褪色,加热后品红溶液恢复至原色。取少量溶液B,滴加KSCN溶液,发现溶液变为血红色。请推测并回答:
(4)用离子反应方程式解释溶液变为血红色的原因:____________________________。
(5)写出形成溶液C的化学方程式:________________________________________。
(6)写出气体A通入溶液B中,发生氧化还原的离子反应方程式:_______________________。
(7)写出化合物甲的化学式______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置,将溶液A逐滴加入固体B中,下列叙述中不正确的是

A. 若a为浓硫酸,b为Na2SO3固体,c中盛石蕊溶液,则c中溶液先变红后褪色
B. 若a为浓盐酸,b为MnO2,c中盛品红溶液,则c中溶液不褪色
C. 若a为醋酸溶液,b为贝壳,c中盛过量澄清石灰水,则c中溶液变浑浊
D. 若a为浓氨水,b为生石灰,c中盛AlCl3溶液,则c中产生白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列推论正确的是
A. NH![]() 为正四面体结构,可推测PH
为正四面体结构,可推测PH![]() 也为正四面体结构
也为正四面体结构
B. SiH4的沸点高于CH4,可推测PH3的沸点高于NH3
C. CO2为非极性分子,可推测SO2也为非极性分子
D. C2H6是碳链为直线型的非极性分子,可推测C3H8也是碳链为直线型的非极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表所示,提纯下列物质(括号内为杂质),所用除杂试剂和分离方法都正确的是
序号 | 不纯物 | 除杂试剂 | 分离方法 |
A | 苯中的少量苯酚 | NaOH溶液 | 分液 |
B | CH4(C2H4) | 酸性KMnO4溶液 | 洗气 |
C | 福尔马林(甲酸) | NaOH溶液 | 分液 |
D | 乙酸乙酯(乙酸) | 饱和的碳酸钠溶液 | 过滤 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,某容积为2L的密闭容器内,某一反应中M(g)、N(g)的物质的量随反应时间变化的曲线如图,依图所示:
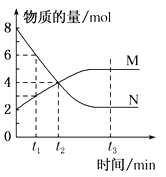
(1)该图形所描述的反应的化学方程式是______________。
(2)在图上所示的三个时刻中,_______(填t1、t2或t3)时刻处于平衡状态,此时v正____v逆(填>、<或=)。
(3)下列描述中能说明上述反应达到平衡状态的是_______。
A.容器中M与N的物质的量之比为1:l
B.混合气体的密度不随时间的变化而变化
C.混合气体的总物质的量不随时间的变化而变化
D.单位时间内消耗2molN的同时生成ImolM
(4)下列措施能增大反应速率的是_______(选填字母)
A.升高温度 B.降低压强 C.减小M的浓度 D.将反应容器体积缩小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标况下,将一装满NO2气体的试管倒置在水槽中,可见试管中液面逐渐上升,反应结束后,试管中所得溶液的物质的量浓度为(忽略溶质的扩散)( )
A. 1 mol/L B. 22.4 mol/L C. 0.045 mol/L D. 0.03 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com