
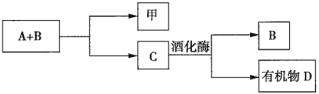
����Ŀ����̼�����Ҫ�ɷ�ΪCeFCO3������ȡϡ�������ұ�������Ҫ����ԭ�ϣ��Է�̼���Ϊԭ����ȡ��Ĺ���������ͼ��ʾ��
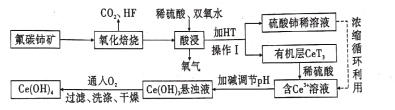
�ش��������⣺
(l)CeFCO3��Ce�Ļ��ϼ�Ϊ____ ��
(2)��������ʱ����ʹ���մ�������ԭ����________����
(3)�������պ�IJ���֮һΪCeO2�������ʱ������Ӧ�����ӷ���ʽΪ____��
(4)HT��һ��������ˮ���л��ܼ��������I������Ϊ _____��
(5)Ϊ���������ʣ������ʵ���߷�Ӧ�¶ȣ����¶�ƫ�߽����ʷ������С����ԭ����____��
(6)�л���HT�ܽ�Ce3+��ˮ��Һ����ȡ�������ù��̿ɱ�ʾΪCe3+��ˮ�㣩+3HT(�л���) ![]() CeT3���л��㣩+3H+��ˮ�㣩����CeT3���л��㣩�м���ϡ�����ܻ�ýϴ��ĺ�Ce3+��ˮ��Һ����ƽ��ǶȽ�����ԭ��________��
CeT3���л��㣩+3H+��ˮ�㣩����CeT3���л��㣩�м���ϡ�����ܻ�ýϴ��ĺ�Ce3+��ˮ��Һ����ƽ��ǶȽ�����ԭ��________��
(7)д����Ce(OH)3����Һ��ͨ�������õ���ƷCe(OH)4�Ļ�ѧ����ʽ��__________________________��
���𰸡�+3 �մɻ������ɵ�HF��Ӧ 2CeO2+H2O2+6H+=2Ce3++O2+4H2O ����ȡ��Һ �¶����ߣ�˫��ˮ�����ֽ⣬��ɽ�����ƫС ���Һ�м���H2SO4��ʹc(H+)����ƽ�����γ�Ge3+ˮ��Һ�����ƶ� 4Ce(OH)3+O2+2H2O=4Ce(OH)4
��������
��̼�����Ҫ�ɷ�ΪCeFCO3�������������ɶ�����̼���������CeO2�����������պ�IJ����м���ϡ�����˫��ˮ���������������������ʧ���ӱ��ֻ�ԭ�ԣ������л���HT�ܽ�Ce3+��ˮ��Һ����ȡ��������+4�۵�Ce�õ�������Ce3+��������ϡ����Һ�м�����ȡ��HT��������ȡ��Һ����Һ�е�Ce3+��ȡ�������ټ���ϡ����ú���Ce3+����Һ��������Һ��pHֵ��Ce(OH)3�������پ����������������ˡ�ϴ�ӡ�����ɵ�Ce(OH)4��Ʒ��
��1�����ݻ��ϼ۴�����Ϊ0����CeԪ�صĻ��ϼۣ�
��2����Ӧ�����ɵ�HF�����մ������к��е�SiO2��Ӧ��
��3�������Ϸ�����֪�������������ɵĶ�������(CeO2)��ϡ���ᡢ˫��ˮ��Ӧ����������Ce3+��
��4����֪HT��һ��������ˮ���л��ܼ�����HT�ܽ�Ce3+��ˮ��Һ����ȡ������������ϡ����Һ�м���HT���õ��л����ˮ��Һ�������I������Ϊ��ȡ��Һ��
��5���¶����ߣ�˫��ˮ�����ֽ⣻
��6������ƽ���ƶ�ԭ�����������Һ�м���H2SO4ʹc(H+)����ƽ�������ƶ���
��7���������̣����Ԫ���غ��֪��Ce(OH)3���������ˮ��Ӧ����Ce(OH)4���ݴ˷�Ӧ�Ļ�ѧ����ʽ��
��̼�����Ҫ�ɷ�ΪCeFCO3�������������ɶ�����̼���������CeO2�����������պ�IJ����м���ϡ�����˫��ˮ���������������������ʧ���ӱ��ֻ�ԭ�ԣ������л���HT�ܽ�Ce3+��ˮ��Һ����ȡ��������+4�۵�Ce�õ�������Ce3+��������ϡ����Һ�м�����ȡ��HT��������ȡ��Һ����Һ�е�Ce3+��ȡ�������ټ���ϡ����ú���Ce3+����Һ��������Һ��pHֵ��Ce(OH)3�������پ����������������ˡ�ϴ�ӡ�����ɵ�Ce(OH)4��Ʒ��
��1��CeFCO3��FԪ��Ϊ1�ۣ�̼Ԫ��Ϊ+4�ۣ���Ԫ��Ϊ2�ۣ��ɸ�Ԫ�ػ��ϼ۴�����Ϊ0���ɼ����CeԪ�صĻ��ϼ�Ϊ+3�ۣ�
�ʴ�Ϊ��+3��
��2����Ӧ�����ɵ�HF�����մ������к��е�SiO2��Ӧ������������ʱ����ʹ���մ�������
�ʴ�Ϊ���մɻ������ɵ�HF��Ӧ��
��3�������Ϸ�����֪�������������ɵĶ�������(CeO2)��ϡ���ᡢ˫��ˮ��Ӧ����������Ce3+�������ʱ������Ӧ�����ӷ���ʽΪ2CeO2+H2O2+6H+=2Ce3++O2+4H2O��
�ʴ�Ϊ��2CeO2+H2O2+6H+=2Ce3++O2+4H2O��
��4����֪HT��һ��������ˮ���л��ܼ�����HT�ܽ�Ce3+��ˮ��Һ����ȡ������������ϡ����Һ�м���HT���õ��л����ˮ��Һ�������I������Ϊ��ȡ��Һ��
�ʴ�Ϊ����ȡ��Һ��
��5���¶����ߣ�˫��ˮ�����ֽ⣬������¶�ƫ�߽����ʷ������С��
�ʴ�Ϊ���¶����ߣ�˫��ˮ�����ֽ⣬��ɽ�����ƫС��
��6������ƽ��Ce3+(ˮ��)+3HT(�л���) CeT3(�л���)+3H+(ˮ��)��֪�����Һ�м���H2SO4ʹc(H+)����ƽ�����γ�Ge3+ˮ��Һ�����ƶ���
�ʴ�Ϊ�����Һ�м���H2SO4��ʹc(H+)����ƽ�����γ�Ge3+ˮ��Һ�����ƶ���
��7���������̣����Ԫ���غ��֪��Ce(OH)3���������ˮ��Ӧ����Ce(OH)4����Ӧ�Ļ�ѧ����ʽΪ4Ce(OH)3+O2+2H2O=4Ce(OH)4��
�ʴ�Ϊ��4Ce(OH)3+O2+2H2O=4Ce(OH)4��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͬϵ��ķ���ʽΪC8H10����֪������ֻ��һ��ȡ����������˵������ȷ����( )
A.���л��ﲻ�ܷ����ӳɷ�Ӧ�����ܷ���ȡ����Ӧ
B.���л��ﲻ��ʹ���Ը��������Һ��ɫ������ʹ��ˮ��ɫ
C.���л����һ�������5�ֽṹ
D.���л�������е�����ԭ�ӿ�����ͬһƽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ�ʹ�����漰��ѧ�仯���ǣ� ��
A.����������ˮ��B.Һ�����������
C.������ʴ����D.С�մ����ʳƷ���ɼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1������������ȷ����________��
A.��˿��������ë����Ҫ�ɷֶ�����ά��
B.����ƽʱ�ԵĶ�������Ҫ���е�����
C.��������ð����Ԫ����һ����֬
D.����ʵ����һ������������Ϊ40%��ȩˮ��Һ��������걾
��2�����������������ؽ����ζ����������ж�֢״����Ҫ���϶Բ��˽������ȡ�
������Ϊ�������ʿ������õ���________��
A.̼�ᱵ B.���� C.��� D.�켦�� E.�ƾ� F.��ţ��
�ڵ�������ѡ���ʶԲ��˽��������Ժ���һ����������________��
A.���鲡�˾���ȥҽԺ����
B.�����˰�����ͨ�紦�������ʵĿ���
C.���鲡���Դ���Ϣ
��3��ѪҺ����һ�ֺ�ͭ�ij���ɫ�ĵ����ʷ��ӣ�����Է�������ԼΪ151000����֪�õ����ʷ�����ͭ����������Ϊ0.34%��ƽ��ÿ���õ����ʷ�����ͭԭ�ӵĸ���Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ŀǰ�ֻ���Ļ��Ҫ�ɱ������������ز��Լ������Һ����ʾ����������ɡ������ǹ�ҵ���ñ�ϩ��A�����л���C��C7H6O3��Ϊԭ�Ϻϳ�Һ����ʾ�����ϣ�F������Ҫ���̣�
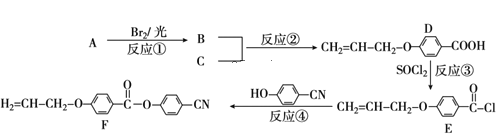
��1��������C�Ľṹ��ʽΪ___��B�Ĺ���������___��
��2������ת������������ȡ����Ӧ����___���Ӧ��ţ���
��3��д��B��NaOHˮ��Һ��Ӧ�Ļ�ѧ����ʽ___��
��4�����й��ڻ�����D��˵����ȷ����___������ĸ����
A.����������� B.1molD�������4molH2�����ӳɷ�Ӧ
C.һ�������·����Ӿ۷�Ӧ D.�˴Ź���������5���
��5��д���������������µĻ�����C��ͬ���칹��Ľṹ��ʽ___(��дһ��)��
�ٱ�����һ�����ֻ��2�� ���ܷ���������Ӧ �۱�������3��ȡ����
��6������������Ʊ����̣�д�����л���C����ϩΪԭ���Ʊ�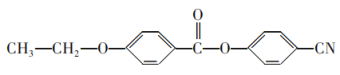 �ĺϳ�·������ͼ�����Լ����ã�___��
�ĺϳ�·������ͼ�����Լ����ã�___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ������˵����ȷ����
A.��״���£�2. 24 L Cl2����ˮ��ַ�Ӧ��ת�Ƶĵ�����Ϊ0.1NA
B.25��ʱ��pH =13��Ba(OH)2��Һ�У�OH-��ĿΪ0. 2NA
C.5.4 gAl�ֱ���Ũ�Ⱦ�Ϊ2 mol��L-1��NaOH��Һ�������100 mL��Ӧ������H2�ķ�������Ϊ0.3.NA
D.31 g����(P4)�����к���P-P����ĿΪ1.5NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ�鷽���ܴﵽʵ��Ŀ�ĵ���
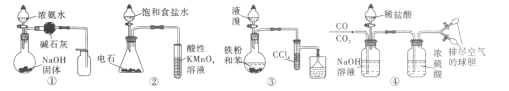
A.��ͼ�ٵ�װ����ȡ���ռ������NH3B.��ͼ�ڵ�װ����֤��Ȳ�Ļ�ԭ��
C.��ͼ�۵�װ����ȡ�屽D.��ͼ�ܵ�װ�÷���CO��CO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C����ֲ�������������ص����ֳ��������ÿ����������Ԫ����������������֣����ǵ��ʣ��л���DҲ�������г��������ʣ���һ�������¿ɷ������·�Ӧ��![]() ������֮������ͼ��ʾ��ת����ϵ��
������֮������ͼ��ʾ��ת����ϵ��
��1���ڻ�����A��B��C��D������Ԫ��������ȫ��ͬ����________������ţ���ͬ����________��
��2���ڳ����£�A��Bͨ��________ת��ΪC���ù�����________��ת��Ϊ________�ܡ�
��3��д����C����D�Ļ�ѧ����ʽ��________________��
��4��Ŀǰ������B�ڴ����еĺ������������ƣ���Ի�����ɵ�Ӱ����________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͭ���仯������������������;�㷺���ش��������⣺
��1��Ŀǰ����ѹ�״�ͭ����������Ҫ�����CuO��ZnO��Al2O3��������ԭ�ӵ����Ų�ͼ��ʾ��״̬�У�������ߵ���__(�����)��
A.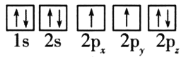 B.
B.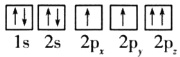
C.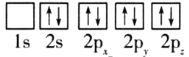 D.
D.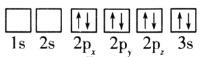
��2��ͭ�����������ڶ���ø�ĸ����ӣ�ij��������Cu+����γ���ͼ��ʾ�����ӡ�
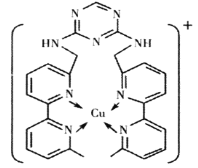
�ٸ������к��л�ѧ����������___(�����)��
A.���Լ� B.���Ӽ� C.�Ǽ��Լ� D.��λ��
��H��N��Cu����Ԫ�صĵ縺���ɴ�С��˳����___��H��N��Cu����Ԫ���γɵ������۵��ɵ͵���˳��Ϊ___��
��3��ij����ͭ�����ṹ��ͼ��ʾ��
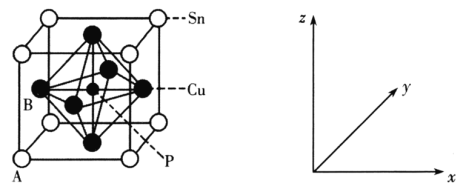
������ԭ���������AΪ(0��0��0)��BΪ(0��![]() ��
��![]() )����Pԭ�ӵ��������Ϊ___��
)����Pԭ�ӵ��������Ϊ___��
�ڸþ����о���Cuԭ�������Snԭ����__������ЩSnԭ�������ֵĹ���Ϊ___��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com