
ЁОЬтФПЁПЭМАЦфЛЏКЯЮядкЩњВњЩњЛюжагУЭОЙуЗКЁЃЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉФПЧАЃЌЕЭбЙМзДМЭЛљДпЛЏМСЕФжївЊзщЗжЪЧCuOЁЂZnOКЭAl2O3ЃЌЯТСабѕдзгЕчзгХХВМЭМБэЪОЕФзДЬЌжаЃЌФмСПзюИпЕФЪЧ__(ЬюађКХ)ЁЃ
A.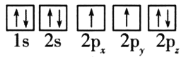 B.
B.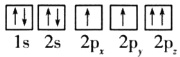
C.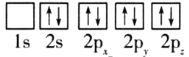 D.
D.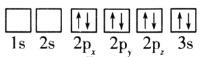
ЃЈ2ЃЉЭРызгЪЧШЫЬхФкЖржжУИЕФИЈвђзгЃЌФГЛЏКЯЮягыCu+НсКЯаЮГЩШчЭМЫљЪОЕФРызгЁЃ
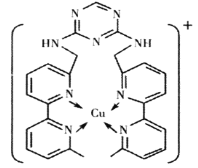
ЂйИУРызгжаКЌгаЛЏбЇМќЕФРраЭга___(ЬюађКХ)ЁЃ
A.МЋадМќ B.РызгМќ C.ЗЧМЋадМќ D.ХфЮЛМќ
ЂкHЁЂNЁЂCuШ§жждЊЫиЕФЕчИКадгЩДѓЕНаЁЕФЫГађЪЧ___ЁЃHЁЂNЁЂCuШ§жждЊЫиаЮГЩЕЅжЪЦфШлЕугЩЕЭЕНИпЫГађЮЊ___ЁЃ
ЃЈ3ЃЉФГСзЧрЭОЇАћНсЙЙШчЭМЫљЪОЃК
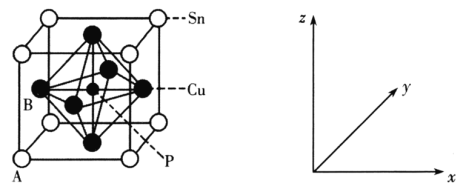
ЂйЦфжадзгзјБъВЮЪ§AЮЊ(0ЃЌ0ЃЌ0)ЃЛBЮЊ(0ЃЌ![]() ЃЌ
ЃЌ![]() )ЁЃдђPдзгЕФзјБъВЮЪ§ЮЊ___ЁЃ
)ЁЃдђPдзгЕФзјБъВЮЪ§ЮЊ___ЁЃ
ЂкИУОЇЬхжаОрРыCuдзгзюНќЕФSnдзгга__ИіЃЌетаЉSnдзгЫљГЪЯжЕФЙЙаЭЮЊ___ЁЃ
ЁОД№АИЁПD ACD NЃОHЃОCu CuЃОN2ЃОH2 (![]() ЃЌ
ЃЌ![]() ЃЌ
ЃЌ![]() ) 4 ЦНУце§ЗНаЮ
) 4 ЦНУце§ЗНаЮ
ЁОНтЮіЁП
ЂХЕчзгдОЧЈЕНИпФмМЖЪБФмСПзюИпЁЃ
ЂЦЂйИУРызгжаКЌгаЛЏбЇМќЕФРраЭЬМЬММќЁЂЬМЧтМќЁЂNЁњCuаЮГЩЕФХфЮЛМќЃЛЂкЭЌжмЦкДгзѓЕНгвЕчИКадж№НЅдіДѓЃЌЭЌжїзхДгЩЯЕНЯТЕчИКадж№НЅМѕаЁЃЛHЁЂNаЮГЩЕЅжЪЪЧЗжзгОЇЬхЃЌЯрЖдЗжзгжЪСПдНДѓЃЌЗЖЕТЛЊСІдНДѓЃЌШлЗаЕудНИпЁЃ
ЂЧЂйPдзгдкЬхаФЃЛЂкИУОЇЬхжаОрРыCuдзгзюНќЕФSnдзгЗжБ№ЮЛгкЭЌвЛИіЦНУце§ЗНЯђЕФЖЅЕуЩЯЁЃ
ЂХЯТСабѕдзгЕчзгХХВМЭМБэЪОЕФзДЬЌжаЃЌЕчзгдОЧЈЕНИпФмМЖЪБФмСПзюИпЃЌвђДЫDжаЕчзгдОЧЈЕН3sФмМЖЃЌвђДЫDжаФмСПзюИпЃЛЙЪД№АИЮЊЃКDЁЃ
ЂЦЂйИУРызгжаКЌгаЛЏбЇМќЕФРраЭЬМЬМЗЧМЋадМќЃЌЬМЧтМЋадМќЃЌNЁњCuаЮГЩЕФХфЮЛМќЃЌЙЪД№АИЮЊЃКACDЁЃ
ЂкЭЌжмЦкДгзѓЕНгвЕчИКадж№НЅдіДѓЃЌЭЌжїзхДгЩЯЕНЯТЕчИКадж№НЅМѕаЁЃЌвђДЫHЁЂNЁЂCuШ§жждЊЫиЕФЕчИКадгЩДѓЕНаЁЕФЫГађЪЧNЃОHЃОCuЁЃHЁЂNаЮГЩЕЅжЪЪЧЗжзгОЇЬхЃЌЯрЖдЗжзгжЪСПдНДѓЃЌЗЖЕТЛЊСІдНДѓЃЌШлЗаЕудНИпЃЌCuаЮГЩЕЅжЪЪЧН№ЪєОЇЬхЃЌШлЗаЕуИпЃЌвђДЫШ§жждЊЫиаЮГЩЕЅжЪЦфШлЕугЩЕЭЕНИпЫГађЮЊCuЃОN2ЃОH2ЃЛЙЪД№АИЮЊЃКNЃОHЃОCuЃЛCuЃОN2ЃОH2ЁЃ
ЂЧЂйЦфжадзгзјБъВЮЪ§AЮЊ(0ЃЌ0ЃЌ0)ЃЛBЮЊ(0ЃЌ![]() ЃЌ
ЃЌ![]() )ЁЃдђPдзгдкЬхаФЃЌИљОнзјБъВЮЪ§ЕУГіPЕФзјБъВЮЪ§ЮЊ(
)ЁЃдђPдзгдкЬхаФЃЌИљОнзјБъВЮЪ§ЕУГіPЕФзјБъВЮЪ§ЮЊ(![]() ЃЌ
ЃЌ![]() ЃЌ
ЃЌ![]() )ЃЛЙЪД№АИЮЊЃК(
)ЃЛЙЪД№АИЮЊЃК(![]() ЃЌ
ЃЌ![]() ЃЌ
ЃЌ![]() )ЁЃ
)ЁЃ
ЂкИУОЇЬхжаОрРыCuдзгзюНќЕФSnдзгЗжБ№ЮЛгкЭЌвЛИіЦНУце§ЗНЯђЕФЖЅЕуЩЯЃЌга4ИіЃЌетаЉSnдзгЫљГЪЯжЕФЙЙаЭЮЊЦНУце§ЗНаЮЃЛЙЪД№АИЮЊЃК4ЃЛЦНУце§ЗНаЮЁЃ


 ПЮЬУаЁзївЕЯЕСаД№АИ
ПЮЬУаЁзївЕЯЕСаД№АИ ЛЦИдаЁзДдЊПкЫуЫйЫуСЗЯАВсЯЕСаД№АИ
ЛЦИдаЁзДдЊПкЫуЫйЫуСЗЯАВсЯЕСаД№АИ ГЩЙІбЕСЗМЦЛЎЯЕСаД№АИ
ГЩЙІбЕСЗМЦЛЎЯЕСаД№АИ БЖЫйбЕСЗЗЈжБЭЈжаПМПМЕуЯЕСаД№АИ
БЖЫйбЕСЗЗЈжБЭЈжаПМПМЕуЯЕСаД№АИ вЛОэИуЖЈЯЕСаД№АИ
вЛОэИуЖЈЯЕСаД№АИ УћаЃзївЕБОЯЕСаД№АИ
УћаЃзївЕБОЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЗњЬМюцПѓЃЈжївЊГЩЗжЮЊCeFCO3ЃЉЪЧЬсШЁЯЁЭСЛЏКЯЮяЁЂвБСЖюцЕФживЊПѓЮядСЯЃЌвдЗњЬМюцПѓЮЊдСЯЬсШЁюцЕФЙЄвеСїГЬШчЭМЫљЪОЁЃ
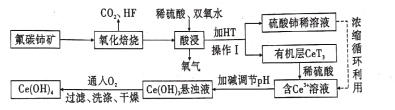
ЛиД№ЯТСаЮЪЬтЃК
(l)CeFCO3жаCeЕФЛЏКЯМлЮЊ____ ЁЃ
(2)бѕЛЏХрЩеЪБВЛФмЪЙгУЬеДЩШнЦїЃЌдвђЪЧ________ЃЎЁЃ
(3)бѕЛЏБКЩеКѓЕФВњЮяжЎвЛЮЊCeO2ЃЎдђЫсНўЪБЗЂЩњЗДгІЕФРызгЗНГЬЪНЮЊ____ЁЃ
(4)HTЪЧвЛжжФбШмгкЫЎЕФгаЛњШмМСЃЌдђВйзїIЕФУћГЦЮЊ _____ЁЃ
(5)ЮЊСЫЬсИпЫсНўТЪЃЌПЩвдЪЪЕБЬсИпЗДгІЮТЖШЃЌЕЋЮТЖШЦЋИпНўГіТЪЗДЖјЛсМѕаЁЃЌЦфдвђЪЧ____ЁЃ
(6)гаЛњЮяHTФмНЋCe3+ДгЫЎШмвКжанЭШЁГіРДЃЌИУЙ§ГЬПЩБэЪОЮЊCe3+ЃЈЫЎВуЃЉ+3HT(гаЛњВу) ![]() CeT3ЃЈгаЛњВуЃЉ+3H+ЃЈЫЎВуЃЉЁЃЯђCeT3ЃЈгаЛњВуЃЉжаМгШыЯЁСђЫсФмЛёЕУНЯДПЕФКЌCe3+ЕФЫЎШмвКЃЌДгЦНКтНЧЖШНтЪЭЦфдвђ________ЁЃ
CeT3ЃЈгаЛњВуЃЉ+3H+ЃЈЫЎВуЃЉЁЃЯђCeT3ЃЈгаЛњВуЃЉжаМгШыЯЁСђЫсФмЛёЕУНЯДПЕФКЌCe3+ЕФЫЎШмвКЃЌДгЦНКтНЧЖШНтЪЭЦфдвђ________ЁЃ
(7)аДГіЯђCe(OH)3аќзЧвКжаЭЈШыбѕЦјЕУЕНВњЦЗCe(OH)4ЕФЛЏбЇЗНГЬЪНЃК__________________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПаЫШЄаЁзщЬНОПSO2ЦјЬхЛЙдFe3+ЁЂI2ЃЌЫќУЧЪЙгУЕФвЉЦЗКЭзАжУШчЭМЫљЪОЃК
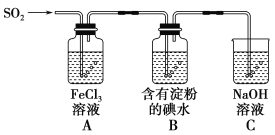
ЃЈ1ЃЉSO2ЦјЬхКЭFe3+ЗДгІЕФбѕЛЏВњЮяЁЂЛЙдВњЮяЗжБ№ЪЧ________ЁЂ________
ЃЈ2ЃЉЯТСаЪЕбщЗНАИЪЪгУгкдкЪЕбщЪвжЦШЁЫљашSO2ЕФЪЧ________ЁЃ
AЃЎNa2SO3ШмвКгыHNO3 BЃЎNa2SO3ЙЬЬхгыХЈСђЫс
CЃЎЙЬЬхСђдкДПбѕжаШМЩе DЃЎЭгыХЈH2SO4ЙВШШ
ЃЈ3ЃЉзАжУCЕФзїгУЪЧ__________________________________________________ЁЃ
ЃЈ4ЃЉзАжУBжаЗДгІЕФРызгЗНГЬЪН_________________________________________________ЁЃ
ЃЈ5ЃЉдкЩЯЪізАжУжаЭЈШыЙ§СПЕФSO2ЃЌЮЊСЫбщжЄAжаSO2гыFe3+ЗЂЩњСЫбѕЛЏЛЙдЗДгІЃЌЫћУЧШЁAжаЕФШмвКЃЌЗжГЩШ§ЗнЃЌВЂЩшМЦСЫШчЯТЪЕбщЃК
ЗНАИЂйЃКЭљЕквЛЗнЪдвКжаМгШыЫсадKMnO4ШмвКЃЌзЯКьЩЋЭЪШЅЁЃ
ЗНАИЂкЃКЭљЕкЖўЗнЪдвКжаМгШыNaOHШмвКЃЌВњЩњАзЩЋГСЕэЃЌВЂбИЫйзЊЮЊЛвТЬЃЌзюКѓГЪКьКжЩЋЁЃ
ЗНАИЂлЃКЭљЕкШ§ЗнЪдвКжаМгШыгУЯЁбЮЫсЫсЛЏЕФBaCl2ЃЌВњЩњАзЩЋГСЕэЁЃ
ЩЯЪіЗНАИВЛКЯРэЕФЪЧЗНАИ_____ЃЌдвђЪЧ__________________________________________________
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЙигкЛЏбЇЗДгІЕФУшЪіжае§ШЗЕФЪЧ
A.ашвЊМгШШВХФмЗЂЩњЕФЗДгІвЛЖЈЪЧЮќШШЗДгІ
B.вбжЊNaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ЁїHЃН-57.3kJ/molЃЌдђКЌ40.0gNaOHЕФЯЁШмвКгыДзЫсЭъШЋжаКЭЃЌЗХГі57.3kJЕФШШСП
C.CO(g)ЕФШМЩеШШЪЧ283.0kJ/molЃЌдђБэЪОCO(g)ЕФШМЩеШШЕФШШЗНГЬЪНЮЊ2CO(g)+O2(g)=2CO2(g) ЁїHЃН-283.0kJ/mol
D.вбжЊ2C(s)+2O2(g)=2CO2(g) ЁїHЃНakJ/molЃЌ2C(s)+O2(g)=2CO(g) ЁїHЃНbkJ/molЃЌдђb>a
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПГЃЮТЯТЃЌдкаТжЦТШЫЎжаЕЮМгNaOHШмвКЃЌШмвКжаЫЎЕчРыГіЕФc(H+)гыNaOHШмвКЕФЬхЛ§жЎМфЕФЙиЯЕШчЭМЫљЪОЃЌЯТСаЭЦЖЯе§ШЗЕФЪЧ

A. гУpHЪджНВтЖЈEЕуЖдгІШмвКЃЌЦфpH = 3
B. HЁЂFЕуЖдгІШмвКжаЖМДцдкЃКc(Na+) = c(Cl-) + c(ClO-)
C. G ЕуЖдгІШмвКжаЃКc(Na+) >c(Cl-) >c(ClO-)>c(OH-) >c(H+)
D. ГЃЮТЯТМгЫЎЯЁЪЭHЕуЖдгІШмвКЃЌШмвКЕФpHдіДѓ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЙ§ЖЩЬЌРэТлШЯЮЊЃКЛЏбЇЗДгІВЂВЛЪЧЭЈЙ§МђЕЅЕФХізВОЭФмЭъГЩЕФЃЌЖјЪЧДгЗДгІЮяЕНЩњГЩЮяЕФЙ§ГЬжаОЙ§вЛИіИпФмСПЕФЙ§ЖЩЬЌЃЎШчЭМIЪЧ1molNO2гы1molCOЧЁКУЗДгІЩњГЩCO2КЭNOЙ§ГЬжаЕФФмСПБфЛЏЪОвтЭМЁЃ
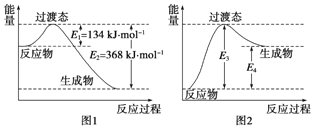
ЃЈ1ЃЉЪдаДГіNO2 КЭCOЗДгІЕФШШЛЏбЇЗНГЬЪНЃК____ЃЎИУЗДгІЕФЛюЛЏФмЪЧ___kJЁЄmol-1
ЃЈ2ЃЉ ЭМ2 ЪЧФГбЇЩњФЃЗТЭМlЛГіЕФNO(g)+CO2(g)= NO2(g)ЪЎCO(g)ЕФФмСПБфЛЏЪОвтЭМЁЃдђЭМжаE3=ЃпkJЁЄmol-1ЃЌE4=____ kJЁЄmol-1
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПНќШеЃЌЮвЙњПЦбаЭХЖгбаЗЂГівЛжжРЖдхШЫдьвЖЦЌЯЕЭГЃЌЦфКЫаФЪЧвЛжжПЩвдЯђЯИАћЭтЗжУкесЬЧЕФРЖдхЃЌЦфЙЄзїдРэШчЭМЁЃЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ

A. ИУЯЕЭГРћгУСЫРЖдхЕФЙтКЯзїгУ
B. РэТлЩЯЃЌЯЕЭГГіЫЎСПаЁгкНјЫЎСП
C. ПЩгУвјАБШмвКМьбщВњЮяжаЪЧЗёКЌесЬЧ
D. ИУЯЕЭГгаЭћЮЊШЫРрЬНЫїЬЋПеЪБНтОіЩњДцФбЬтЬсЙЉаТЫМТЗ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁППЦбЇМвбажЦЕФвЛжжЪЙЩГФЎБфТЬжоЕФаТММЪѕЃЌМДдкЩГФЎжаХчШївЛЖЈСПЕФОлБћЯЉЫсѕЅЃЈ![]() ЃЉгыЫЎЕФЛьКЯЮяЃЌЪЙЦфгыЩГСЃНсКЯЃЌМШФмзшжЙЕиЯТЕФбЮЗжЩЯЩ§ЃЌгжФмРЙНиЁЂаюЛ§гъЫЎЁЃЯТСаЖдОлБћЯЉЫсѕЅЕФа№Ъіжае§ШЗЕФЪЧЃЈЁЁЁЁЃЉ
ЃЉгыЫЎЕФЛьКЯЮяЃЌЪЙЦфгыЩГСЃНсКЯЃЌМШФмзшжЙЕиЯТЕФбЮЗжЩЯЩ§ЃЌгжФмРЙНиЁЂаюЛ§гъЫЎЁЃЯТСаЖдОлБћЯЉЫсѕЅЕФа№Ъіжае§ШЗЕФЪЧЃЈЁЁЁЁЃЉ
ЂйОлБћЯЉЫсѕЅЕФЕЅЬхЕФНсЙЙМђЪНЮЊCH2=CHCOOR
ЂкОлБћЯЉЫсѕЅУЛгаЙЬЖЈЕФШлЁЂЗаЕу
ЂлОлБћЯЉЫсѕЅдквЛЖЈЬѕМўЯТФмЗЂЩњЫЎНтЗДгІКЭМгГЩЗДгІ
ЂмЦфОлКЯЗНЪНгыЗгШЉЪїжЌЕФОлКЯЗНЪНЯрЭЌ
A.ЂйЂкB.ЂлЂмC.ЂйЂкЂлD.ЂйЂкЂлЂм
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПCЁЂNЁЂSЕФбѕЛЏЮяГЃЛсдьГЩвЛаЉЛЗОГЮЪЬтЃЌПЦбаЙЄзїепе§дкбаОПгУИїжжЛЏбЇЗНЗЈРДЯћГ§етаЉЮяжЪЖдЛЗОГЕФВЛРћгАЯьЁЃ
![]() ФђЫи
ФђЫи![]() ЪЧвЛжжЗЧГЃживЊЕФИпаЇЕЊЗЪЃЌЙЄвЕЩЯвд
ЪЧвЛжжЗЧГЃживЊЕФИпаЇЕЊЗЪЃЌЙЄвЕЩЯвд![]() ЁЂ
ЁЂ![]() ЮЊдСЯЩњВњФђЫиЃЌИУЗДгІЪЕМЪЮЊСНВНЗДгІЃК
ЮЊдСЯЩњВњФђЫиЃЌИУЗДгІЪЕМЪЮЊСНВНЗДгІЃК
ЕквЛВНЃК![]()
![]()
ЕкЖўВНЃК![]()
![]()
аДГіЙЄвЕЩЯвд![]() ЁЂ
ЁЂ![]() ЮЊдСЯКЯГЩФђЫиКЭ
ЮЊдСЯКЯГЩФђЫиКЭ![]() ЕФШШЛЏбЇЗНГЬЪНЃК_________ЁЃ
ЕФШШЛЏбЇЗНГЬЪНЃК_________ЁЃ
![]() вЛЖЈЮТЖШЯТЃЌЯђ
вЛЖЈЮТЖШЯТЃЌЯђ![]() КуШнУмБеШнЦїжаЭЈШы
КуШнУмБеШнЦїжаЭЈШы![]() КЭ
КЭ![]() ЃЌЗЂЩњЗДгІ
ЃЌЗЂЩњЗДгІ![]() ЁЃШєЗДгІНјааЕН
ЁЃШєЗДгІНјааЕН![]() ЪБДяЕНЦНКтЃЌВтЕУ
ЪБДяЕНЦНКтЃЌВтЕУ![]() ЕФЬхЛ§ЗжЪ§ЮЊ
ЕФЬхЛ§ЗжЪ§ЮЊ![]() ЃЌдђЧА
ЃЌдђЧА![]() ФкЦНОљЗДгІЫйТЪ
ФкЦНОљЗДгІЫйТЪ![]() ________ЃЌИУЮТЖШЯТЗДгІЕФЛЏбЇЦНКтГЃЪ§
________ЃЌИУЮТЖШЯТЗДгІЕФЛЏбЇЦНКтГЃЪ§![]() ________ЁЃ
________ЁЃ
![]() ЙЄвЕЩЯПЩгУNaClOМюадШмвКЛђЁАбЧСђЫсбЮЗЈЁБЮќЪе
ЙЄвЕЩЯПЩгУNaClOМюадШмвКЛђЁАбЧСђЫсбЮЗЈЁБЮќЪе![]() ЁЃ
ЁЃ
![]() ЮЊСЫЬсИпЮќЪеаЇТЪЃЌГЃгУ
ЮЊСЫЬсИпЮќЪеаЇТЪЃЌГЃгУ![]() зїЮЊДпЛЏМСЁЃДпЛЏЙ§ГЬШчЭМ1ЫљЪОЁЃ
зїЮЊДпЛЏМСЁЃДпЛЏЙ§ГЬШчЭМ1ЫљЪОЁЃ
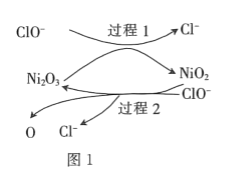
![]() Й§ГЬ2ЕФЗДгІЪНЮЊ____________ЁЃ
Й§ГЬ2ЕФЗДгІЪНЮЊ____________ЁЃ
![]() вВПЩгУгкЭбСђЃЌЧвЭбСђаЇЙћБШNaClOИќКУЃЌдвђЪЧ_________ЁЃ
вВПЩгУгкЭбСђЃЌЧвЭбСђаЇЙћБШNaClOИќКУЃЌдвђЪЧ_________ЁЃ
![]() ЪвЮТЯТЃЌ
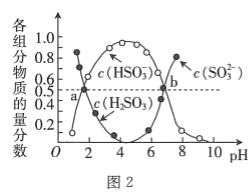
ЪвЮТЯТЃЌ![]() ШмвКжаКЌСђзщЗжЮяжЪЕФСПЗжЪ§ЫцШмвКpHЕФБфЛЏЙиЯЕШчЭМ2ЫљЪОЃЌbЕуЪБШмвК
ШмвКжаКЌСђзщЗжЮяжЪЕФСПЗжЪ§ЫцШмвКpHЕФБфЛЏЙиЯЕШчЭМ2ЫљЪОЃЌbЕуЪБШмвК![]() ЃЌдђ
ЃЌдђ![]() ________ЁЃ
________ЁЃ
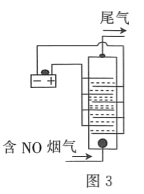
![]() гУЪГбЮЫЎзїЕчНтвКЕчНтбЬЦјЭбЕЊЕФдРэШчЭМ3ЫљЪОЃЌМюадЬѕМўЯТNOБЛбєМЋВњЩњЕФ
гУЪГбЮЫЎзїЕчНтвКЕчНтбЬЦјЭбЕЊЕФдРэШчЭМ3ЫљЪОЃЌМюадЬѕМўЯТNOБЛбєМЋВњЩњЕФ![]() бѕЛЏЮЊ
бѕЛЏЮЊ![]() ЃЌЮВЦјОЧтбѕЛЏФЦШмвКЮќЪеКѓХХШыПеЦјЁЃМюадЬѕМўЯТNOБЛбєМЋВњЩњЕФбѕЛЏадЮяжЪбѕЛЏЮЊ
ЃЌЮВЦјОЧтбѕЛЏФЦШмвКЮќЪеКѓХХШыПеЦјЁЃМюадЬѕМўЯТNOБЛбєМЋВњЩњЕФбѕЛЏадЮяжЪбѕЛЏЮЊ![]() ЕФРызгЗНГЬЪНЮЊ________ЁЃ
ЕФРызгЗНГЬЪНЮЊ________ЁЃ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com