
【题目】(1)下列叙述正确的有________。
A.蚕丝、棉花和羊毛的主要成分都是纤维素
B.我们平时吃的豆腐中主要含有蛋白质
C.“病毒感冒”的元凶是一种油脂
D.生物实验室一般用质量分数为40%甲醛水溶液保存生物标本
(2)如果发现有人误服重金属盐而出现了轻微中毒症状,需要马上对病人进行抢救。
①你认为下列物质可以利用的有________。
A.碳酸钡 B.豆浆 C.碘酒 D.熟鸡蛋 E.酒精 F.生牛奶
②当你用所选物质对病人进行抢救以后,下一步的做法是________。
A.建议病人尽快去医院治疗
B.将病人安置于通风处呼吸新鲜的空气
C.建议病人卧床休息
(3)血液中有一种含铜的呈蓝色的蛋白质分子,其相对分子质量约为151000。已知该蛋白质分子中铜的质量分数为0.34%,平均每个该蛋白质分子中铜原子的个数为________。
【答案】BD BF A 8
【解析】
(1)棉花的主要成分是纤维素,蚕丝、羊毛、豆腐的主要成分是蛋白质,故A错误,B正确;病毒是蛋白质,C错误;40%甲醛水溶液可使蛋白质变性,可用于保存生物标本,D正确;故答案为:BD;
(2)①豆浆和生牛奶中含有较多的未变性的蛋白质,可以与重金属盐作用,从而降低其对人体的伤害,熟鸡蛋中的蛋白质已经变性,不能与重金属盐作用,故答案为:BF;
②重金属盐中毒者服用生牛奶等虽然能降低重金属盐对人体的伤害,但不能完全消除,病人去医院进行更有效的治疗才是最佳选择,故答案为:A;
(3) ![]() ,已知该蛋白质分子中铜的质量分数为0.34%,则Cu原子的个数为
,已知该蛋白质分子中铜的质量分数为0.34%,则Cu原子的个数为![]() ,故答案为:8。
,故答案为:8。


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
【题目】氯原子对O3的分解有催化作用:
O3+Cl=ClO+O2 ΔH1
ClO+O=Cl+O2 ΔH2
该反应的能量变化如图所示,下列叙述中正确的是( )
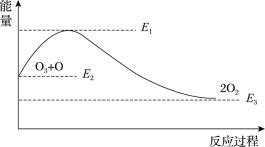
A.反应O3+O=2O2的ΔH=E1-E2
B.反应O3+O=2O2的ΔH=E2-E3
C.反应O3+O=2O2是吸热反应
D.反应O3+O=2O2的ΔH=ΔH1+ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有单质A、B、C及化合物D、E、F、G、H,它们之间能发生如图反应(图中有些反应的产物和反应的条件没有全部标出)。
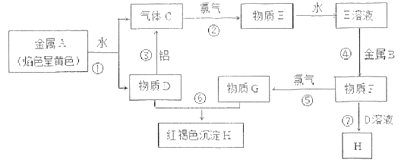
请根据以上信息回答下列问题:
(1)反应③是D物质的水溶液与金属铝反应,金属铝被氧化___(写化学式);
(2)步骤⑦中刚生成的白色沉淀颜色会迅速发生变化,最终生成红褐色沉淀H,请写出由白色沉淀变成H的化学方程式:___;
(3)检验G中所含的金属离子时,在G溶液中加入硫氰化钾溶液,离子方程式为:___;
(4)工业上将氯气通入D溶液中制取消毒液,反应的化学方程式为___,1mol氯气发生反应,转移电子___mol;消毒液中的有效成分是___(填名称);
(5)将0.1molA的碳酸盐溶液和0.15molE溶液混合,有如下两种方式:
A.将含A的碳酸盐溶液逐滴加入到E溶液中;
B.将E溶液逐滴加入到含A的碳酸盐溶液中;
理论上产生气体比较多的是___(填序号),多___mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.05mol·L-1的某稀酸H2B溶液中滴入0.1mol·L-1氨水,溶液中由水电离出氢离子浓度随滴入氨水体积变化如图。下列分析正确的是( )

A. NaHB溶液可能为酸性,也可能为碱性
B. A、B、C三点溶液的pH是逐渐减小,D、E、F三点溶液的pH是逐渐增大
C. E溶液中离子浓度大小关系:c(NH4+)>c(B2-)>c(OH-)>c(H+)
D. F点溶液c(NH4+)=2c(B2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辛烷(C8H18)是汽油的重要成分,其与O2反应的能量变化如图所示。下列判断正确的是
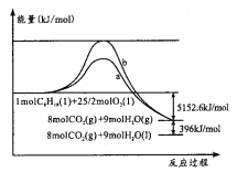
A. 曲线b代表加入催化剂时的能量变化
B. 反应物的总能量小于生成物的总能量
C. 表示辛烷燃烧热的热化学方程式:C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(g) ΔH=-5152.6kJ/mol
D. 反应a、b的活化能不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配合物Fe(CO)5的熔点一20℃,沸点103℃。可用于制备纯铁。Fe(CO)5的结构如图所示。

(1)基态Fe原子的价电子排布式是_____________________;Fe(CO)5晶体类型属于__________晶体。
(2)CO分子中C、O原子都满足8电子稳定结构,CO分子的结构式是________,写出与CO互为等电子体的分子的电子式:___________________。
(3)C、O、Fe的第一电离能由大到小的顺序为_______________________。
(4)关于Fe(CO)5,下列说法正确的是______。
A. Fe(CO)5是非极性分子,CO是极性分子 B. Fe(CO)5中Fe原子以sp3杂化方式与CO成键
C.1molFe(CO)5含有10mol配位键 D.Fe(CO)5==Fe+5CO反应中没有新化学键生成
(5)铁的三种晶体的晶胞均为立方晶胞,三种晶体的晶胞如下图所示。

①上述三种晶体的晶胞中属于面心晶胞的是______(填“a”“δ””或“γ”)-Fe。
②a-Fe晶胞中铁原子的配位数为_______________。
③γ-Fe晶胞的边长为apm,则γ-Fe单质的密度为____g/cm3(NA表示阿伏伽德罗常数的值,列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟碳铈矿(主要成分为CeFCO3)是提取稀土化合物、冶炼铈的重要矿物原料,以氟碳铈矿为原料提取铈的工艺流程如图所示。
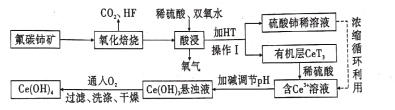
回答下列问题:
(l)CeFCO3中Ce的化合价为____ 。
(2)氧化培烧时不能使用陶瓷容器,原因是________.。
(3)氧化焙烧后的产物之一为CeO2.则酸浸时发生反应的离子方程式为____。
(4)HT是一种难溶于水的有机溶剂,则操作I的名称为 _____。
(5)为了提高酸浸率,可以适当提高反应温度,但温度偏高浸出率反而会减小,其原因是____。
(6)有机物HT能将Ce3+从水溶液中萃取出来,该过程可表示为Ce3+(水层)+3HT(有机层) ![]() CeT3(有机层)+3H+(水层)。向CeT3(有机层)中加入稀硫酸能获得较纯的含Ce3+的水溶液,从平衡角度解释其原因________。
CeT3(有机层)+3H+(水层)。向CeT3(有机层)中加入稀硫酸能获得较纯的含Ce3+的水溶液,从平衡角度解释其原因________。
(7)写出向Ce(OH)3悬浊液中通入氧气得到产品Ce(OH)4的化学方程式:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸亚乙酯是一种重要的添加剂,其结构简式为![]() 。用环氧乙烷合成碳酸亚乙酯的反应为:
。用环氧乙烷合成碳酸亚乙酯的反应为: 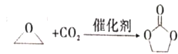 下列说法错误的是
下列说法错误的是
A.碳酸亚乙酯中的所有原子处于同一平面内B.碳酸亚乙酯的二氯代物只有两种
C.上述反应属于加成反应D.1 mol碳酸亚乙酯最多可消耗2 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学反应的描述中正确的是
A.需要加热才能发生的反应一定是吸热反应
B.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=-57.3kJ/mol,则含40.0gNaOH的稀溶液与醋酸完全中和,放出57.3kJ的热量
C.CO(g)的燃烧热是283.0kJ/mol,则表示CO(g)的燃烧热的热方程式为2CO(g)+O2(g)=2CO2(g) △H=-283.0kJ/mol
D.已知2C(s)+2O2(g)=2CO2(g) △H=akJ/mol,2C(s)+O2(g)=2CO(g) △H=bkJ/mol,则b>a
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com