
【题目】氨在工农业及国防工业上有广泛的用途。
(1)已知:
①4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) △H=-1266.2k/mol
2N2(g)+6H2O(g) △H=-1266.2k/mol
②2H2(g)+O2(g)![]() 2H2O(g) △H=-483.6kJ/mol
2H2O(g) △H=-483.6kJ/mol
则合成氨反应N2(g)+3H2(g)![]() 2NH3(g) △H=___________kJ/mol,该反应属于___________。
2NH3(g) △H=___________kJ/mol,该反应属于___________。
A.高温自发 B.低温自发 C.恒自发 D.恒不自发
(2)在甲、乙、丙三个容积均为2L的密闭装置中,均充人4mol合成气,但N2、H2的投料比不同,在400℃时反应,测定N2的体积百分含量,得到下图一。
①乙装置中N2、H2的投料比为___________。
②反应达到平衡后,测得乙装置中H2的体积百分含量为25%,则400℃时,合成氨反应的平衡常数为___________(不须注明单位)。
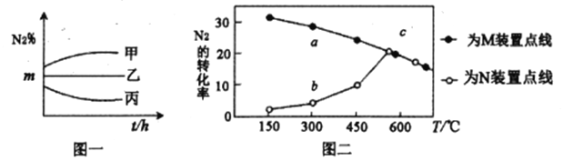
(3)在M、N两个装置中分别充入相同投料比的N2、H2,进行合成氨反应,各反应1小时,测定不同温度下N2的转化率,得到上图二。
①N2、H2在M、N两装置中反应时,不同的条件可能是______________________。
②在300℃时,a、b两点转化率差异的原因是______________________。
(4)氨法烟气脱硫技术渐趋成熟,回收SO2,并产出氮肥,其流程分两步:
①氨水吸收烟气中的SO2:xNH3+SO2(g)+H2O====(NH4)xH2-xSO3
②加入足量的磷酸得到纯净的SO2。写出该反应的化学方程式:______________________。
【答案】-92.3 B 1:1 3.125 M装置中使用了催化剂 M装置中使用了催化剂,a点速率快,达到了平衡,b点速率慢,没达到平衡 (NH4)xH2-xSO3+xH3PO4=xNH4H2PO4+SO2↑+H2O
【解析】
(1)从盖斯定律的计算和反应进行的方向分析;(2)综合考察影响化学平衡移动因素、平衡常数计算、转化率计算等为题。
(1)、已知:①4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g),△H=-1266.2k/mol ;②2H2(g)+O2(g)
2N2(g)+6H2O(g),△H=-1266.2k/mol ;②2H2(g)+O2(g)![]() 2H2O(g),△H=-483.6kJ/mol,则合成氨反应N2(g)+3H2(g)
2H2O(g),△H=-483.6kJ/mol,则合成氨反应N2(g)+3H2(g)![]() 2NH3(g),△H=-①/2+3/2②代入得,△H= -92.3 k/mol,反应后气体体积变小,是一个熵减的反应(ΔS<0),由△H-T△S可知ΔH<0,ΔS<0时,在低温下能自发进行。
2NH3(g),△H=-①/2+3/2②代入得,△H= -92.3 k/mol,反应后气体体积变小,是一个熵减的反应(ΔS<0),由△H-T△S可知ΔH<0,ΔS<0时,在低温下能自发进行。
本题答案:△H= -92.3 k/mol;B
(2)、设N2初始投料为a mol,由“三段式”得:
N2(g) + 3H2(g)![]() 2NH3(g)
2NH3(g)
起始量(mol): a 4-a 0
变化量(mol): x 3x 2x
平衡量(mol):a-x 4-a-3x 2x
①由题意知N2体积分数为![]() =常数,当a=2时该比值为常数0.5,则N2有2mol,H2有2mol,N2、H2的投料比为1:1。
=常数,当a=2时该比值为常数0.5,则N2有2mol,H2有2mol,N2、H2的投料比为1:1。
②H2的体积百分含量为25%,则![]() ,a=2,则x=0.4,故平衡常数K=
,a=2,则x=0.4,故平衡常数K=![]()
(3)、①相同温度下,相同时间内,M装置中N2转化率比N装置大,则M反应速率也大于N,故M装置中使用了催化剂。
本题答案:M装置中使用了催化剂
②在同温度下,由于M装置中使用了催化剂,其反应速率快得多,在300℃时,a点速率快,先达到了平衡;而b点反应速率慢,还没有达到平衡状态,这是造成a、b两点转化率有差异的原因。
本题答案:M装置中使用了催化剂,a点速率快,达到了平衡,b点速率慢,没达到平衡
(4) 第一步中生成的 (NH4)xH2-xSO3为酸式盐,可与磷酸中H+结合产生SO2和H2O,故第二步加入足量的磷酸反应方程式为 (NH4)xH2-xSO3+xH3PO4=xNH4H2PO4+SO2↑+H2O
本题答案:(NH4)xH2-xSO3+xH3PO4=xNH4H2PO4+SO2↑+H2O


科目:高中化学 来源: 题型:
【题目】碳酸亚乙酯是一种重要的添加剂,其结构简式为![]() 。用环氧乙烷合成碳酸亚乙酯的反应为:
。用环氧乙烷合成碳酸亚乙酯的反应为: 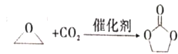 下列说法错误的是
下列说法错误的是
A.碳酸亚乙酯中的所有原子处于同一平面内B.碳酸亚乙酯的二氯代物只有两种
C.上述反应属于加成反应D.1 mol碳酸亚乙酯最多可消耗2 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学反应的描述中正确的是
A.需要加热才能发生的反应一定是吸热反应
B.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=-57.3kJ/mol,则含40.0gNaOH的稀溶液与醋酸完全中和,放出57.3kJ的热量
C.CO(g)的燃烧热是283.0kJ/mol,则表示CO(g)的燃烧热的热方程式为2CO(g)+O2(g)=2CO2(g) △H=-283.0kJ/mol
D.已知2C(s)+2O2(g)=2CO2(g) △H=akJ/mol,2C(s)+O2(g)=2CO(g) △H=bkJ/mol,则b>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过渡态理论认为:化学反应并不是通过简单的碰撞就能完成的,而是从反应物到生成物的过程中经过一个高能量的过渡态.如图I是1molNO2与1molCO恰好反应生成CO2和NO过程中的能量变化示意图。
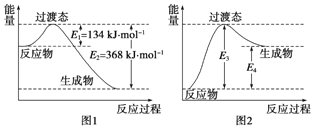
(1)试写出NO2 和CO反应的热化学方程式:____.该反应的活化能是___kJ·mol-1
(2) 图2 是某学生模仿图l画出的NO(g)+CO2(g)= NO2(g)十CO(g)的能量变化示意图。则图中E3=_kJ·mol-1,E4=____ kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近日,我国科研团队研发出一种蓝藻人造叶片系统,其核心是一种可以向细胞外分泌蔗糖的蓝藻,其工作原理如图。下列说法不正确的是

A. 该系统利用了蓝藻的光合作用
B. 理论上,系统出水量小于进水量
C. 可用银氨溶液检验产物中是否含蔗糖
D. 该系统有望为人类探索太空时解决生存难题提供新思路
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物M的结构简式为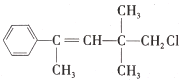 。关于该有机物,下列叙述不正确的是( )
。关于该有机物,下列叙述不正确的是( )
A.M不能与NaOH的醇溶液发生反应
B.1 mol M最多能与4 mol H2发生加成反应
C.M与NaOH溶液共热后,再AgNO3溶液产生白色沉淀
D.M既能使溴水褪色又能使KMnO4酸性溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家研制的一种使沙漠变绿洲的新技术,即在沙漠中喷洒一定量的聚丙烯酸酯(![]() )与水的混合物,使其与沙粒结合,既能阻止地下的盐分上升,又能拦截、蓄积雨水。下列对聚丙烯酸酯的叙述中正确的是( )
)与水的混合物,使其与沙粒结合,既能阻止地下的盐分上升,又能拦截、蓄积雨水。下列对聚丙烯酸酯的叙述中正确的是( )
①聚丙烯酸酯的单体的结构简式为CH2=CHCOOR
②聚丙烯酸酯没有固定的熔、沸点
③聚丙烯酸酯在一定条件下能发生水解反应和加成反应
④其聚合方式与酚醛树脂的聚合方式相同
A.①②B.③④C.①②③D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了实现“将全球温度上升幅度控制在![]() 以内”的目标,科学家正在研究温室气体
以内”的目标,科学家正在研究温室气体![]() 的转化和利用。
的转化和利用。
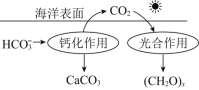
![]() 海洋是地球上碳元素的最大“吸收池”。在海洋中,可通过如图所示的途径来固碳。发生光合作用时,
海洋是地球上碳元素的最大“吸收池”。在海洋中,可通过如图所示的途径来固碳。发生光合作用时,![]() 与
与![]() 反应生成
反应生成![]() 和
和![]() 的化学方程式为________。
的化学方程式为________。
![]() 在一定温度和催化剂作用下,
在一定温度和催化剂作用下,![]() 与
与![]() 可直接转化成乙酸,这是实现“减排”的一种研究方向。
可直接转化成乙酸,这是实现“减排”的一种研究方向。
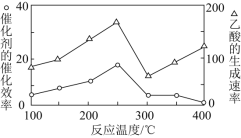
![]() 在不同温度下,催化剂的催化效率与乙酸的生成速率如下图所示,则该反应的最佳温度应控制在________左右。
在不同温度下,催化剂的催化效率与乙酸的生成速率如下图所示,则该反应的最佳温度应控制在________左右。
![]() 该反应催化剂的有效成分为偏铝酸亚铜
该反应催化剂的有效成分为偏铝酸亚铜![]() ,难溶物
,难溶物![]() 。将
。将![]() 溶解在稀硝酸中生成两种盐并放出NO气体,其离子方程式为________。
溶解在稀硝酸中生成两种盐并放出NO气体,其离子方程式为________。
![]() 有科学家提出可利用
有科学家提出可利用![]() 来吸收
来吸收![]() ,已知:
,已知:
![]()
![]()
则![]() ________
________![]() 。
。
![]() 往2L恒容密闭容器中充入
往2L恒容密闭容器中充入![]() 和
和![]() ,一定条件下发生反应:
,一定条件下发生反应:![]() 。在不同催化剂作用下,相同时间内
。在不同催化剂作用下,相同时间内![]() 的转化率随温度变化如下图所示
的转化率随温度变化如下图所示![]() 图中c点的转化率为
图中c点的转化率为![]() ,即转化了
,即转化了![]() 。
。
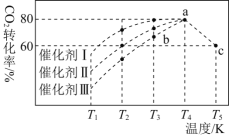
![]() 催化剂效果最佳的是________
催化剂效果最佳的是________![]() 填“催化剂Ⅰ”“催化剂Ⅱ”或“催化剂Ⅲ”
填“催化剂Ⅰ”“催化剂Ⅱ”或“催化剂Ⅲ”![]() 。
。
![]() 点
点![]() 正
正![]() ________
________![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 逆
逆![]() 。
。
![]() 若此反应在a点时已达到平衡状态,a点的转化率比c点高的原因是________。
若此反应在a点时已达到平衡状态,a点的转化率比c点高的原因是________。
![]() 点时该反应的平衡常数
点时该反应的平衡常数![]() ________。
________。
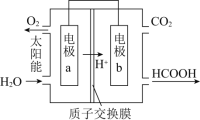
![]() 直接排放煤燃烧产生的烟气会引起严重的环境问题,将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。下图是通过人工光合作用,以
直接排放煤燃烧产生的烟气会引起严重的环境问题,将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。下图是通过人工光合作用,以![]() 和
和![]() 为原料制备HCOOH和
为原料制备HCOOH和![]() 的原理示意图。电极b表面的电极反应式为________。
的原理示意图。电极b表面的电极反应式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式见如图,取足量的Na、NaOH(aq)和NaHCO3(aq)分别和等物质的量的该物质在一定条件下反应(必要时可以加热),完全反应后消耗的Na、NaOH和NaHCO3三种物质的物质的量之比是

A.3∶4∶2B.3∶5∶1C.3∶5∶2D.3∶4∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com