
【题目】为了实现“将全球温度上升幅度控制在![]() 以内”的目标,科学家正在研究温室气体
以内”的目标,科学家正在研究温室气体![]() 的转化和利用。
的转化和利用。
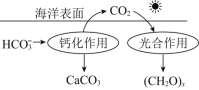
![]() 海洋是地球上碳元素的最大“吸收池”。在海洋中,可通过如图所示的途径来固碳。发生光合作用时,
海洋是地球上碳元素的最大“吸收池”。在海洋中,可通过如图所示的途径来固碳。发生光合作用时,![]() 与
与![]() 反应生成
反应生成![]() 和
和![]() 的化学方程式为________。
的化学方程式为________。
![]() 在一定温度和催化剂作用下,
在一定温度和催化剂作用下,![]() 与
与![]() 可直接转化成乙酸,这是实现“减排”的一种研究方向。
可直接转化成乙酸,这是实现“减排”的一种研究方向。
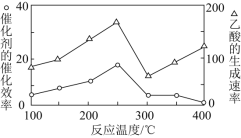
![]() 在不同温度下,催化剂的催化效率与乙酸的生成速率如下图所示,则该反应的最佳温度应控制在________左右。
在不同温度下,催化剂的催化效率与乙酸的生成速率如下图所示,则该反应的最佳温度应控制在________左右。
![]() 该反应催化剂的有效成分为偏铝酸亚铜
该反应催化剂的有效成分为偏铝酸亚铜![]() ,难溶物
,难溶物![]() 。将
。将![]() 溶解在稀硝酸中生成两种盐并放出NO气体,其离子方程式为________。
溶解在稀硝酸中生成两种盐并放出NO气体,其离子方程式为________。
![]() 有科学家提出可利用
有科学家提出可利用![]() 来吸收
来吸收![]() ,已知:
,已知:
![]()
![]()
则![]() ________
________![]() 。
。
![]() 往2L恒容密闭容器中充入
往2L恒容密闭容器中充入![]() 和
和![]() ,一定条件下发生反应:
,一定条件下发生反应:![]() 。在不同催化剂作用下,相同时间内
。在不同催化剂作用下,相同时间内![]() 的转化率随温度变化如下图所示
的转化率随温度变化如下图所示![]() 图中c点的转化率为
图中c点的转化率为![]() ,即转化了
,即转化了![]() 。
。
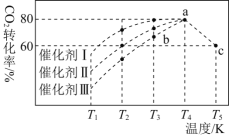
![]() 催化剂效果最佳的是________
催化剂效果最佳的是________![]() 填“催化剂Ⅰ”“催化剂Ⅱ”或“催化剂Ⅲ”
填“催化剂Ⅰ”“催化剂Ⅱ”或“催化剂Ⅲ”![]() 。
。
![]() 点
点![]() 正
正![]() ________
________![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 逆
逆![]() 。
。
![]() 若此反应在a点时已达到平衡状态,a点的转化率比c点高的原因是________。
若此反应在a点时已达到平衡状态,a点的转化率比c点高的原因是________。
![]() 点时该反应的平衡常数
点时该反应的平衡常数![]() ________。
________。
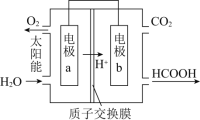
![]() 直接排放煤燃烧产生的烟气会引起严重的环境问题,将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。下图是通过人工光合作用,以
直接排放煤燃烧产生的烟气会引起严重的环境问题,将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。下图是通过人工光合作用,以![]() 和
和![]() 为原料制备HCOOH和
为原料制备HCOOH和![]() 的原理示意图。电极b表面的电极反应式为________。
的原理示意图。电极b表面的电极反应式为________。
【答案】xH2O+xCO2![]() (CH2O)x+xO2
(CH2O)x+xO2 ![]()
![]()
![]() 催化剂Ⅰ
催化剂Ⅰ ![]() 该反应为放热反应,温度升高,平衡逆向移动
该反应为放热反应,温度升高,平衡逆向移动 ![]() 或
或![]()
![]()
【解析】
(1)CO2与H2O反应生成(CH2O)x和O2,据此写出反应的化学方程式;
(2)①根据乙酸反应速率最大、催化活性最高选择;
②CuAlO2溶解在稀硝酸中生成两种盐并放出NO气体,生成的盐为硝酸铝、硝酸铜,反应还有水生成,配平书写离子方程式;
(3)①C(s)+2H2O(g)CO2(g)+2H2(g)△H=+113.4KJmol-1
②3FeO(s)+H2O(g)Fe3O4(s)+H2(g)△H=+18.7KJmol-1
盖斯定律计算②×2-①得到6FeO(s)+CO2(g)2Fe3O4(s)+C(s)反应的热化学方程式;
(4)①使用不同的催化剂,催化效果不一定,CO的转化率不一样,根据图象分析;
②温度升高,仍能继续反应,说明该温度时反应尚未达到化学平衡,反应仍能向右进行;
③若此反应在a点时已达平衡状态,a点的转化率比c点高,根据图象,温度升高,从a到c过程中CO2转化率降低,温度升高,说明温度升高不利于反应正向进行;
④c点的转化率为66.67%,即转化了![]() ,起始时往2L恒容密闭容器中充入1molCO2和3molH2,根据方程式计算化学平衡常数K;
,起始时往2L恒容密闭容器中充入1molCO2和3molH2,根据方程式计算化学平衡常数K;
(5)由图可知,左室投入水,生成氧气与氢离子,催化剂a表面发生氧化反应,为负极,右室通入二氧化碳,酸性条件下生成HCOOH,原电池工作时,电子由负极经外电路流向正极.
![]() 发生光合作用时,
发生光合作用时,![]() 与
与![]() 在叶绿素和酶的作用下反应生成
在叶绿素和酶的作用下反应生成![]() 和
和![]() ,其反应的化学方程式为
,其反应的化学方程式为![]() ,故答案为:
,故答案为:![]() ;
;
![]() 由图可以看出
由图可以看出![]() 时,乙酸的生成速率最大,催化剂的催化效率最高,则该反应的最佳温度应控制在
时,乙酸的生成速率最大,催化剂的催化效率最高,则该反应的最佳温度应控制在![]() 左右,故答案为:
左右,故答案为:![]() ;
;
![]() 将
将![]() 溶解在稀硝酸中生成的盐为硝酸铝、硝酸铜,反应还有水生成,其离子方程式为
溶解在稀硝酸中生成的盐为硝酸铝、硝酸铜,反应还有水生成,其离子方程式为![]() ,故答案为:
,故答案为:![]() ;
;
![]() ,
,![]()
![]() ,则由
,则由![]() 可得反应
可得反应
![]() ,
,![]()
![]() ,故答案为:
,故答案为:![]() ;
;
![]() 由图可以看出,温度相同时,相同时间内使用催化剂Ⅰ
由图可以看出,温度相同时,相同时间内使用催化剂Ⅰ![]() 的转化率最大,催化剂效果最佳的是催化剂Ⅰ,故答案为:催化剂Ⅰ;
的转化率最大,催化剂效果最佳的是催化剂Ⅰ,故答案为:催化剂Ⅰ;
![]() 由图可以看出,反应从正反应开始,b点还未达到化学平衡状态,
由图可以看出,反应从正反应开始,b点还未达到化学平衡状态,![]() 正
正![]() 逆
逆![]() ,故答案为:
,故答案为:![]() ;
;
![]() 若此反应在a点时已达到平衡状态,a点的转化率比c点高,是因为该反应为放热反应,温度升高,平衡逆向移动,故答案为:该反应为放热反应,温度升高,平衡逆向移动;
若此反应在a点时已达到平衡状态,a点的转化率比c点高,是因为该反应为放热反应,温度升高,平衡逆向移动,故答案为:该反应为放热反应,温度升高,平衡逆向移动;
![]() 点时,
点时, ![]()
起始![]() :
:![]()
![]() 0 0
0 0
转化![]() :
:![]()
![]()
![]()
![]()
平衡![]() :
:![]()
![]()
![]()
![]()
c点时该反应的平衡常数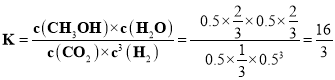 ,故答案为:
,故答案为:![]() 或
或![]() ;
;
![]() 该装置中,根据
该装置中,根据![]() 流向知,a是负极,b是正极,正极得电子发生还原反应,反应式为
流向知,a是负极,b是正极,正极得电子发生还原反应,反应式为![]() ;
;
故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】氨在工农业及国防工业上有广泛的用途。
(1)已知:
①4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) △H=-1266.2k/mol
2N2(g)+6H2O(g) △H=-1266.2k/mol
②2H2(g)+O2(g)![]() 2H2O(g) △H=-483.6kJ/mol
2H2O(g) △H=-483.6kJ/mol
则合成氨反应N2(g)+3H2(g)![]() 2NH3(g) △H=___________kJ/mol,该反应属于___________。
2NH3(g) △H=___________kJ/mol,该反应属于___________。
A.高温自发 B.低温自发 C.恒自发 D.恒不自发
(2)在甲、乙、丙三个容积均为2L的密闭装置中,均充人4mol合成气,但N2、H2的投料比不同,在400℃时反应,测定N2的体积百分含量,得到下图一。
①乙装置中N2、H2的投料比为___________。
②反应达到平衡后,测得乙装置中H2的体积百分含量为25%,则400℃时,合成氨反应的平衡常数为___________(不须注明单位)。
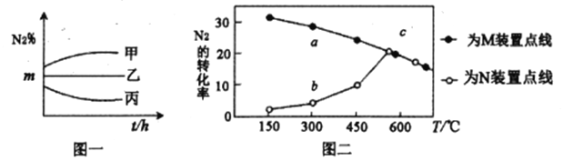
(3)在M、N两个装置中分别充入相同投料比的N2、H2,进行合成氨反应,各反应1小时,测定不同温度下N2的转化率,得到上图二。
①N2、H2在M、N两装置中反应时,不同的条件可能是______________________。
②在300℃时,a、b两点转化率差异的原因是______________________。
(4)氨法烟气脱硫技术渐趋成熟,回收SO2,并产出氮肥,其流程分两步:
①氨水吸收烟气中的SO2:xNH3+SO2(g)+H2O====(NH4)xH2-xSO3
②加入足量的磷酸得到纯净的SO2。写出该反应的化学方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为![]() ,还含有杂质
,还含有杂质![]() 和
和![]() )提取氧化铝并冶炼
)提取氧化铝并冶炼![]() 的操作过程如下:
的操作过程如下:
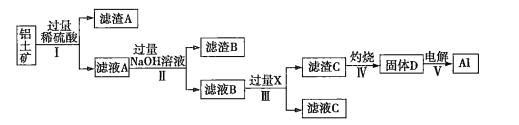
(1)滤渣A是______,滤渣B是__________。
(2)操作Ⅰ、Ⅱ、Ⅲ的名称是____________。
(3)生成滤渣C的离子方程式为___________________________________________。
(4)取100 mL滤液B,加入200mL 1.0 ![]() 的盐酸时,沉淀量达到最大且质量为11.7g。则滤液B中
的盐酸时,沉淀量达到最大且质量为11.7g。则滤液B中![]() ________,
________,![]() _______
_______ ![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇既是重要的化工原料,又是电动公交车的清洁能源,利用水煤气在一定条件下含成甲醇,发生的反应为:![]() ?
?![]() 已知CO、
已知CO、![]() 、
、![]() 的燃烧热分别为283.0kJ/mol,285.8kJ/mol,726.5kJ/mol,则
的燃烧热分别为283.0kJ/mol,285.8kJ/mol,726.5kJ/mol,则![]() ______。
______。![]() 在一容积为2L的恒容密闭容器中加入
在一容积为2L的恒容密闭容器中加入![]() CO和
CO和![]()
![]() ,发生如下反应:CO
,发生如下反应:CO![]() ,实验测得
,实验测得![]() 和
和![]() 下,甲醇的物质的量随时间的变化如表所示,下列说法正确的是
下,甲醇的物质的量随时间的变化如表所示,下列说法正确的是
时间 | 10min | 20min | 30min | 40min | 50min | 60min |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
![]() 由上述数据可以判断:
由上述数据可以判断:![]() ______
______![]()
![]() 时,
时,![]() 的平均反应速率
的平均反应速率![]() ______。
______。![]() 该反应
该反应![]() 达到平衡后,为同时提高反应速率和甲醇的生成量,以下措施一定可行的是______
达到平衡后,为同时提高反应速率和甲醇的生成量,以下措施一定可行的是______![]() 选填编号
选填编号![]() 。
。
A 改用高效催化剂![]() 升高溫度
升高溫度![]() 缩小容器体积
缩小容器体积 ![]() 分离出甲醇
分离出甲醇 ![]() 增加CO的浓度
增加CO的浓度![]() 若保持
若保持![]() 不变,起始时加入CO、
不变,起始时加入CO、![]() 、
、![]() 的物质的量分别为amol、bmol、cmol,达到平衡时,仍与原平衡等效,则a、b、c应该满足的条件______。
的物质的量分别为amol、bmol、cmol,达到平衡时,仍与原平衡等效,则a、b、c应该满足的条件______。![]() 当反应在
当反应在![]() 达到20min时,控制体积不变,迅速将
达到20min时,控制体积不变,迅速将![]() ,
,![]() ,
,![]() 同时投入体系中,后在恒压条件下,反应在40min时达到平衡,请在图中画出20~40min内容器中
同时投入体系中,后在恒压条件下,反应在40min时达到平衡,请在图中画出20~40min内容器中![]() 浓度的变化趋势曲线:______
浓度的变化趋势曲线:______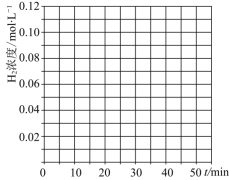
![]() 在以
在以![]() 为燃料的燃料电池中,电解质溶液为酸性,则负极的电极反应式为______;理想状态下,该燃料电池消耗2mol甲醇所能产生的最大电能为1162.4kJ,则该燃料电池的理论效率为______。
为燃料的燃料电池中,电解质溶液为酸性,则负极的电极反应式为______;理想状态下,该燃料电池消耗2mol甲醇所能产生的最大电能为1162.4kJ,则该燃料电池的理论效率为______。![]() 燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比
燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮及其化合物在生产、生活中广泛存在。
(1)煤气化的化学方程式为:C(s)+H2O(g)==CO(g)+H2(g) H,该反应在高温下能自发进行,则H_____0(填“>”或“<”)。
(2)煤气化的产物可用于合成甲醇。已知,在刚性容器中,有关反应及其在不同温度下的化学平衡常数如下表所示。
相关化学反应方程式 | 平衡 常数 | 温度(0C) | ||
500 | 700 | 800 | ||
(a)2H2(g)+CO(g) | K1 | 2.5 | 0.34 | 0.15 |
(b)H2(g)+CO2(g) | K2 | 1.0 | 1.70 | 2.52 |
(c)3H2(g)+CO2(g) | K3 | |||
①H1、H2、H3的关系是_____________,H3______0 (填“>”或“<”)
②下列措施能使反应(c)的平衡体系中n(CH3OH):n(CO2)增大的是_______(填字母代号)。
A.将H2O (g)从体系中分离出去 B.充入He (g)
C.升高温度 D.充入1mol H2 (g)
③500℃时,测得反应(c)在某时刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度分別为1.0mol·L-1、0.20mol·L-1、0.50mol·L-1、0.40mol·L-1,则此时反应(c)________。
A.向正反应方向进行 B.向逆反应方向进行
C.处于平衡状态 D.无法判断反应状态
(3)CO2

(4)汽车尾气主要有害物质是CO和NO,提高其转化效率是重要的研究课题。在密闭容器中充入5.0 mol CO和4.0 mol NO,发生以下反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H = -746 kJ·mol-1平衡时,NO的转化率与温度、压强的关系如图所示。
N2(g)+2CO2(g) △H = -746 kJ·mol-1平衡时,NO的转化率与温度、压强的关系如图所示。

①温度:T1_____T2(填“<”或“>”),
② 某温度下,反应达到平衡状态P点时,此时的平衡常数Kp=________________________(只列计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,![]() 和
和![]() 的电离常数分别为
的电离常数分别为![]() 和
和![]() 。将
。将![]() 和体积均相同的两种酸溶液分别稀释,其
和体积均相同的两种酸溶液分别稀释,其![]() 随加水体积的变化如图所示。下列叙述正确的是( )
随加水体积的变化如图所示。下列叙述正确的是( )

A. 曲线Ⅰ代表![]() 溶液
溶液
B. 溶液中水的电离程度:b点>c点
C. 从c点到d点,溶液中 保持不变(其中
保持不变(其中![]() 、
、![]() 分别代表相应的酸和酸根离子)
分别代表相应的酸和酸根离子)
D. 相同体积a点的两溶液分别与![]() 恰好中和后,溶液中
恰好中和后,溶液中![]() 相同
相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列微粒中中心原子的杂化方式和微粒的立体构型均正确的是( )
A.C2H4:sp、平面形
B.SO![]() :sp3、三角锥形
:sp3、三角锥形
C.ClO![]() :sp3、V形
:sp3、V形
D.NO![]() :sp3、正四面体
:sp3、正四面体
查看答案和解析>>
科目:高中化学 来源: 题型:
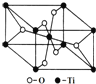
【题目】金属钛呈银白色,因它坚硬、强度大、耐热、密度小,被称为高技术金属。目前生产钛采用氯化法,主要步骤如下:
Ⅰ.即将金红石或钛铁矿与焦炭混合,通入氯气并加热制得TiCl4:
2FeTiO3+7Cl2+6C![]() 2TiCl4+2FeCl3+6CO
2TiCl4+2FeCl3+6CO
TiO2+2Cl2+2C![]() TiCl4+2CO
TiCl4+2CO
Ⅱ.将TiCl4蒸馏并提纯,在氩气保护下与镁共热得到钛:
TiCl4+2Mg![]() Ti+2MgCl2
Ti+2MgCl2
Ⅲ.用稀盐酸溶解MgCl2和过量Mg后得海绵状钛,再在真空熔化铸成钛锭。
请回答下列问题:
(1)基态钛原子的价电子排布式为___。
(2)与CO互为等电子体的离子为___(填化学式)。
(3)在CH2Cl2、HCHO、CO2、C2H4中,碳原子采取sp2杂化的分子有___。
(4)TiCl4在常温下是无色液体,在水或潮湿空气中易水解而冒白烟。则TiCl4属于___(填“原子”“分子”或“离子”)晶体。
(5)与钛同周期的另一种元素钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,其中一种化学式为[Co(NH3)5Br]SO4,往其溶液中加BaCl2溶液时,现象是___;往另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则第二种配合物的化学式为___。
(6)在自然界中TiO2有金红石、板钛矿、锐钛矿三种晶型,其中金红石的晶胞如图所示,则其中Ti4+的配位数为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com