
【题目】碳、氮及其化合物在生产、生活中广泛存在。
(1)煤气化的化学方程式为:C(s)+H2O(g)==CO(g)+H2(g) H,该反应在高温下能自发进行,则H_____0(填“>”或“<”)。
(2)煤气化的产物可用于合成甲醇。已知,在刚性容器中,有关反应及其在不同温度下的化学平衡常数如下表所示。
相关化学反应方程式 | 平衡 常数 | 温度(0C) | ||
500 | 700 | 800 | ||
(a)2H2(g)+CO(g) | K1 | 2.5 | 0.34 | 0.15 |
(b)H2(g)+CO2(g) | K2 | 1.0 | 1.70 | 2.52 |
(c)3H2(g)+CO2(g) | K3 | |||
①H1、H2、H3的关系是_____________,H3______0 (填“>”或“<”)
②下列措施能使反应(c)的平衡体系中n(CH3OH):n(CO2)增大的是_______(填字母代号)。
A.将H2O (g)从体系中分离出去 B.充入He (g)
C.升高温度 D.充入1mol H2 (g)
③500℃时,测得反应(c)在某时刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度分別为1.0mol·L-1、0.20mol·L-1、0.50mol·L-1、0.40mol·L-1,则此时反应(c)________。
A.向正反应方向进行 B.向逆反应方向进行
C.处于平衡状态 D.无法判断反应状态
(3)CO2

(4)汽车尾气主要有害物质是CO和NO,提高其转化效率是重要的研究课题。在密闭容器中充入5.0 mol CO和4.0 mol NO,发生以下反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H = -746 kJ·mol-1平衡时,NO的转化率与温度、压强的关系如图所示。
N2(g)+2CO2(g) △H = -746 kJ·mol-1平衡时,NO的转化率与温度、压强的关系如图所示。

①温度:T1_____T2(填“<”或“>”),
② 某温度下,反应达到平衡状态P点时,此时的平衡常数Kp=________________________(只列计算式)。
【答案】> H3 = H1+H2 < AD A CO2 + H2O + 2e- == HCOOH+O2- > 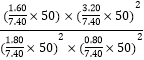
【解析】
(1)反应C(s)+H2O(g)==CO(g)+H2(g)中S>0,G=H-TS<0,根据该反应在高温下能自发进行,则H>0;
(2) ①已知(a)2H2(g)+CO(g)![]() CH3OH(g) H1
CH3OH(g) H1
(b)H2(g)+CO2(g)![]() H2O(g)+CO(g) H2
H2O(g)+CO(g) H2
根据盖斯定律,由(a)+ (b)得反应(c)3H2(g)+CO2(g)![]() CH3OH(g)+H2O(g) H3=H1+H2;
CH3OH(g)+H2O(g) H3=H1+H2;
根据反应可得K3= K1K2,由表中数据计算得5000C、7000C、8000C时的值分别为2.5×1.0=2.5、0.34×1.70=0.578、0.15×2.52=0.378,故升高温度K3值减小,反应(c)为放热反应,H3<0;
②要使n(CH3OH):n(CO2)增大,应使平衡向正反应方向移动,
A.将H2O(g)从体系中分离,平衡向正反应方法移动,n(CH3OH):n(CO2)增大,选项A正确;
B.充入He(g),使体系压强增大,但对反应物质来说,浓度没有变化,平衡不移动,n(CH3OH):n(CO2)不变,选项B错误;
C.因正反应放热,升高温度平衡向逆反应方向移动,则n(CH3OH):n(CO2)减小,选项C错误;
D.再充入1mol H2,平衡向正反应方向移动,则n(CH3OH):n(CO2)增大,选项D正确。
答案选AD;
③ 500℃时,测得反应(c)在某时刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度分別为1.0mol·L-1、0.20mol·L-1、0.50mol·L-1、0.40mol·L-1,则Q=![]() ,此时反应(c)向正反应方向进行,答案选A;
,此时反应(c)向正反应方向进行,答案选A;
(3)电解池中阴离子定向移动到阳极,根据氧离子定向移动到b极,则b极为阳极,CO2和水在a处得电子转化为HCOOH,在电解池中阴极上得电子发生还原反应,故阴极的电极反应为CO2 + H2O + 2e- == HCOOH+O2-;
(4) ①反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H = -746 kJ·mol-1为放热反应,升高温度平衡逆向移动,NO的转化率降低,故T1>T2;
N2(g)+2CO2(g) △H = -746 kJ·mol-1为放热反应,升高温度平衡逆向移动,NO的转化率降低,故T1>T2;
② 某温度下,反应达到平衡状态P点时,NO的转化率为80%,则平衡时CO、NO、N2、CO2的物质的量分别为1.8mol、0.8mol、1.6mol、3.2mol,平衡时气体总物质的量为7.4mol,总压为50MPa,各气体的分压为![]() 、
、![]() 、
、![]() 、
、![]() ,此时的平衡常数Kp=img src="http://thumb.zyjl.cn/questionBank/Upload/2019/05/10/08/e68ff7ce/SYS201905100837397580273619_DA/SYS201905100837397580273619_DA.001.png" width="144" height="60" style="-aw-left-pos:0pt; -aw-rel-hpos:column; -aw-rel-vpos:paragraph; -aw-top-pos:0pt; -aw-wrap-type:inline" />。
,此时的平衡常数Kp=img src="http://thumb.zyjl.cn/questionBank/Upload/2019/05/10/08/e68ff7ce/SYS201905100837397580273619_DA/SYS201905100837397580273619_DA.001.png" width="144" height="60" style="-aw-left-pos:0pt; -aw-rel-hpos:column; -aw-rel-vpos:paragraph; -aw-top-pos:0pt; -aw-wrap-type:inline" />。


科目:高中化学 来源: 题型:
【题目】科学家设想用结构相似的C60与Si60合成种类似工艺品“套球”(如图所示)的球型碳硅化合物Si60C60,外层球壳原子与里层球壳原子通过共价键结合。下列说法一定正确的是

A.该物质与碳化硅(SiC)互为同素异形体
B.该物质结构中,外层球壳为C60,内层球壳为Si60
C.该物质形成的晶体是分子晶体
D.该物质的熔点高、硬度大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g) + B(g)3C(g) + 4D(g)中,表示该反应速率最快的是
A. v(A)=0.05 mol/(L·S)
B. v(B)=0.3 mol/(L·min)
C. v(C)=1.2 mol/(L·min)
D. v(D)=0.6 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水晒盐的母液中提取金属镁的一种工艺流程如下:

下列说法不正确的是
A. 步骤① 沉镁可加入石灰乳,说明Mg(OH)2的溶解度更小
B. 步骤③ 脱水时,在空气中加热MgCl2·6H2O得到MgCl2
C. 步骤④ 电解熔融MgCl2时,阴极有金属Mg析出
D. 设计步骤① 、② 、③ 的主要目的是富集镁元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下CO(g)和H2(g)发生反应:CO(g) +2H2(g) CH3OH(g)。在容积固定且均为1 L的a、b、c三个密闭容器中分别充入1 mol CO (g)和2 mol H2 (g),三个容器的反应温度分别为T1、T2、T3(依次升高)且恒定不变,测得反应均进行到5 min时CH3OH (g)的浓度如下图所示。下列说法正确的

A. 该反应的正反应△H >0
B. 当三个容器内的反应都达到化学平衡时,CO转化率最大的是α(a)
C. 三个容器中平衡常数最大的是c容器中的平衡常数
D. 反应均进行到5min时,b点一定达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】兴趣小组用莫尔盐[化学式为(NH4)xFe(SO4)2·yH2O(Fe为+2价)]测定KMnO4溶液的物质的量浓度的过程如下:
①称取19.6g莫尔盐配成100mL溶液,溶液中c(Fe2+)=0.5mol/L。
②量取10.00mL KMnO4溶液,向其中加入足量的H2SO4进行酸化,向酸化后的溶液中逐滴滴加莫尔盐溶液,反应完全时消耗莫尔盐溶液的体积为20.00mL。所发生反应的离子方程式如下:4H++5Fe2++MnO=5Fe3++Mn2++4H2O
请回答下列问题:
(1)(NH4)xFe(SO4)2·yH2O中x=______,y=______。
(2)第①步实验中所需的玻璃仪器除量筒、烧杯、胶头滴管外还有______;
用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移、定容等操作。下列图示对应的操作规范的是______。

(3)KMnO4溶液的物质的量浓度c(KMnO4)=______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列条件一定能使反应速率加快的是
①增加反应物的物质的量 ②升高温度 ③缩小反应容器的体积
④加入生成物 ⑤加入MnO2
A. 全部 B. ①②⑤ C. ② D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置。下列叙述不正确的是

A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为Cu2++2e-=Cu
C. 无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色
D. a和b用导线连接时,铁片作正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察下图,下列叙述正确的是

A. 若该图表示的是活细胞的各化学元素的含量,则甲为碳元素
B. 若该图表示的是细胞各化学元素占干重的百分比,则甲为氧元素
C. 若该图为活细胞的化合物组成情况,则甲中含有的元素为C、H、0
D. 若该图是完全脱水后的细胞的化合物组成情况,则甲是蛋白质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com