
【题目】工业上用铝土矿(主要成分为![]() ,还含有杂质
,还含有杂质![]() 和
和![]() )提取氧化铝并冶炼
)提取氧化铝并冶炼![]() 的操作过程如下:
的操作过程如下:
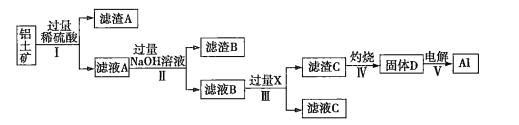
(1)滤渣A是______,滤渣B是__________。
(2)操作Ⅰ、Ⅱ、Ⅲ的名称是____________。
(3)生成滤渣C的离子方程式为___________________________________________。
(4)取100 mL滤液B,加入200mL 1.0 ![]() 的盐酸时,沉淀量达到最大且质量为11.7g。则滤液B中
的盐酸时,沉淀量达到最大且质量为11.7g。则滤液B中![]() ________,
________,![]() _______
_______ ![]() 。
。
【答案】![]()
![]() (或氢氧化铁) 过滤
(或氢氧化铁) 过滤 ![]()
![]() 6.0
6.0
【解析】
铝土矿中加入过量稀硫酸,二氧化硅不与稀硫酸反应形成滤渣A,氧化铁、氧化铝与稀硫酸反应生成铝离子、铁离子,滤液A中有铝离子、铁离子;滤液A中加入过量的氢氧化钠溶液生成氢氧化铁沉淀和偏铝酸钠。根据固体D电解生成铝,推知D为氧化铝,C为氢氧化铝。偏铝酸钠与过量的X生成氢氧化铝,推知X为二氧化碳。
(1)铝土矿中的二氧化硅与稀硫酸不反应,则滤渣A是![]() (或二氧化硅);滤液A中含有铝离子、铁离子,加入过量的氢氧化钠,则滤渣B是
(或二氧化硅);滤液A中含有铝离子、铁离子,加入过量的氢氧化钠,则滤渣B是![]() (或氢氧化铁)。
(或氢氧化铁)。
(2)操作Ⅰ、Ⅱ、Ⅲ后分为滤渣和滤液,故名称均是过滤。
(3)由于二氧化碳是过量的,则生成滤渣C的离子方程式为![]() 。
。
(4)取100mL滤液B,加入200mL![]() 的盐酸时,沉淀量达到最大且质量为11.7g,即氢氧化铝是11.7g,其物质的量是
的盐酸时,沉淀量达到最大且质量为11.7g,即氢氧化铝是11.7g,其物质的量是![]() ,根据铝原子守恒可知,滤液B中
,根据铝原子守恒可知,滤液B中![]() 。根据方程式
。根据方程式![]() 可知
可知![]() 消耗氢氧化钠0.6 mol,又因为氢氧化钠还会与硫酸等反应,因此最终滤液B中
消耗氢氧化钠0.6 mol,又因为氢氧化钠还会与硫酸等反应,因此最终滤液B中![]() 的浓度大于
的浓度大于![]() 。
。


 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】向某密闭容器中加入 0.3 mol A、0.1 mol C 和一定量的 B 三种气体, 一定条件下发生如下反应: 3A(g) ![]() B(g)+2C(g),各物质的浓度随时间变化如图所示[t0~t1 阶段的 c(B)变化未画出]。下列说法中正确的是( )
B(g)+2C(g),各物质的浓度随时间变化如图所示[t0~t1 阶段的 c(B)变化未画出]。下列说法中正确的是( )

A. 若 t1=15 s,则用 A 的浓度变化表示 t0~t1阶段的平均反应速率为 0.004 mol·L-1·s-1
B. t1时该反应达到平衡, A 的转化率为 60%
C. 该容器的容积为2 L,B的起始的物质的量为 0.02 mol
D. t0~t1 阶段, 此过程中容器与外界的热交换总量为 a kJ,该反应的热化学方程式为 3A(g)![]() B(g)+2C(g) ΔH=-50a kJ·mol-1
B(g)+2C(g) ΔH=-50a kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过渡态理论认为:化学反应并不是通过简单的碰撞就能完成的,而是从反应物到生成物的过程中经过一个高能量的过渡态.如图I是1molNO2与1molCO恰好反应生成CO2和NO过程中的能量变化示意图。
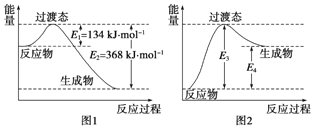
(1)试写出NO2 和CO反应的热化学方程式:____.该反应的活化能是___kJ·mol-1
(2) 图2 是某学生模仿图l画出的NO(g)+CO2(g)= NO2(g)十CO(g)的能量变化示意图。则图中E3=_kJ·mol-1,E4=____ kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物M的结构简式为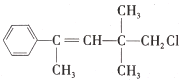 。关于该有机物,下列叙述不正确的是( )
。关于该有机物,下列叙述不正确的是( )
A.M不能与NaOH的醇溶液发生反应
B.1 mol M最多能与4 mol H2发生加成反应
C.M与NaOH溶液共热后,再AgNO3溶液产生白色沉淀
D.M既能使溴水褪色又能使KMnO4酸性溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家研制的一种使沙漠变绿洲的新技术,即在沙漠中喷洒一定量的聚丙烯酸酯(![]() )与水的混合物,使其与沙粒结合,既能阻止地下的盐分上升,又能拦截、蓄积雨水。下列对聚丙烯酸酯的叙述中正确的是( )
)与水的混合物,使其与沙粒结合,既能阻止地下的盐分上升,又能拦截、蓄积雨水。下列对聚丙烯酸酯的叙述中正确的是( )
①聚丙烯酸酯的单体的结构简式为CH2=CHCOOR
②聚丙烯酸酯没有固定的熔、沸点
③聚丙烯酸酯在一定条件下能发生水解反应和加成反应
④其聚合方式与酚醛树脂的聚合方式相同
A.①②B.③④C.①②③D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 和
和![]() 是两种重要的温室气体,通过
是两种重要的温室气体,通过![]() 和
和![]() 反应制造更高价值化学品是目前的研究目标。
反应制造更高价值化学品是目前的研究目标。
![]() 时,以镍合金为催化剂,向
时,以镍合金为催化剂,向![]() 容器中通入
容器中通入![]() 、
、![]() ,发生如下反应:
,发生如下反应:![]() 。平衡体系中各组分体积分数如下表:
。平衡体系中各组分体积分数如下表:
物质 |
|
| CO |
|
体积分数 |
|
|
|
|
![]() 此温度下该反应的平衡常数
此温度下该反应的平衡常数![]() __________
__________
![]() 已知:
已知:![]()
![]()
![]()
![]()
![]()
反应![]() 的
的![]() _____________
_____________![]()
![]() 以二氧化钛表面覆盖
以二氧化钛表面覆盖![]() 为催化剂,可以将
为催化剂,可以将![]() 和
和![]() 直接转化成乙酸。
直接转化成乙酸。
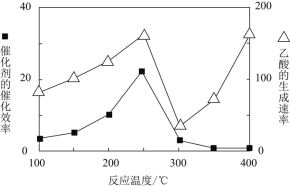
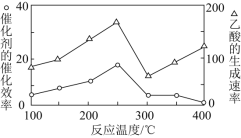
![]() 在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。
在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。![]() 时,温度升高而乙酸的生成速率降低的原因是___________。
时,温度升高而乙酸的生成速率降低的原因是___________。
![]() 为了提高该反应中
为了提高该反应中![]() 的转化率,可以采取的措施是_________。
的转化率,可以采取的措施是_________。
![]() 、
、![]() 、MgO均能吸收
、MgO均能吸收![]() ;
;
![]() 如果寻找吸收
如果寻找吸收![]() 的其他物质,下列建议不合理的是______
的其他物质,下列建议不合理的是______
![]() 可在具有强氧化性的物质中寻找
可在具有强氧化性的物质中寻找
![]() 可在碱性氧化物中寻找
可在碱性氧化物中寻找
![]() 可在ⅠA、ⅡA族元素形成的氧化物中寻找
可在ⅠA、ⅡA族元素形成的氧化物中寻找
![]() 吸收
吸收![]() 后,产物用于合成
后,产物用于合成![]() ,
,![]() 用于吸收、释放
用于吸收、释放![]() ,原理是:在
,原理是:在![]() ,
,![]() 与
与![]() 接触后生成
接触后生成![]() ;平衡后加热至
;平衡后加热至![]() ,反应逆向进行,放出
,反应逆向进行,放出![]() ,
,![]() 再生,说明该原理的化学方程式是_____________。
再生,说明该原理的化学方程式是_____________。
![]() 高温电解技术能高效实现下列反应:
高温电解技术能高效实现下列反应: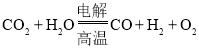 ,其可将释放的
,其可将释放的![]() 转化为具有工业利用价值的产品。工作原理示意图如下:
转化为具有工业利用价值的产品。工作原理示意图如下:
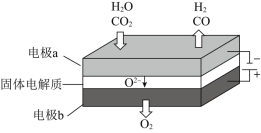
![]() 在电极a放电的电极反应式是____________。
在电极a放电的电极反应式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了实现“将全球温度上升幅度控制在![]() 以内”的目标,科学家正在研究温室气体
以内”的目标,科学家正在研究温室气体![]() 的转化和利用。
的转化和利用。
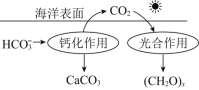
![]() 海洋是地球上碳元素的最大“吸收池”。在海洋中,可通过如图所示的途径来固碳。发生光合作用时,
海洋是地球上碳元素的最大“吸收池”。在海洋中,可通过如图所示的途径来固碳。发生光合作用时,![]() 与
与![]() 反应生成
反应生成![]() 和
和![]() 的化学方程式为________。
的化学方程式为________。
![]() 在一定温度和催化剂作用下,
在一定温度和催化剂作用下,![]() 与
与![]() 可直接转化成乙酸,这是实现“减排”的一种研究方向。
可直接转化成乙酸,这是实现“减排”的一种研究方向。
![]() 在不同温度下,催化剂的催化效率与乙酸的生成速率如下图所示,则该反应的最佳温度应控制在________左右。
在不同温度下,催化剂的催化效率与乙酸的生成速率如下图所示,则该反应的最佳温度应控制在________左右。
![]() 该反应催化剂的有效成分为偏铝酸亚铜
该反应催化剂的有效成分为偏铝酸亚铜![]() ,难溶物
,难溶物![]() 。将
。将![]() 溶解在稀硝酸中生成两种盐并放出NO气体,其离子方程式为________。
溶解在稀硝酸中生成两种盐并放出NO气体,其离子方程式为________。
![]() 有科学家提出可利用
有科学家提出可利用![]() 来吸收
来吸收![]() ,已知:
,已知:
![]()
![]()
则![]() ________
________![]() 。
。
![]() 往2L恒容密闭容器中充入
往2L恒容密闭容器中充入![]() 和
和![]() ,一定条件下发生反应:
,一定条件下发生反应:![]() 。在不同催化剂作用下,相同时间内
。在不同催化剂作用下,相同时间内![]() 的转化率随温度变化如下图所示
的转化率随温度变化如下图所示![]() 图中c点的转化率为
图中c点的转化率为![]() ,即转化了
,即转化了![]() 。
。
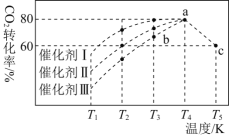
![]() 催化剂效果最佳的是________
催化剂效果最佳的是________![]() 填“催化剂Ⅰ”“催化剂Ⅱ”或“催化剂Ⅲ”
填“催化剂Ⅰ”“催化剂Ⅱ”或“催化剂Ⅲ”![]() 。
。
![]() 点
点![]() 正
正![]() ________
________![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 逆
逆![]() 。
。
![]() 若此反应在a点时已达到平衡状态,a点的转化率比c点高的原因是________。
若此反应在a点时已达到平衡状态,a点的转化率比c点高的原因是________。
![]() 点时该反应的平衡常数
点时该反应的平衡常数![]() ________。
________。
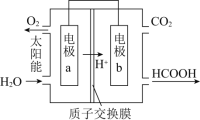
![]() 直接排放煤燃烧产生的烟气会引起严重的环境问题,将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。下图是通过人工光合作用,以
直接排放煤燃烧产生的烟气会引起严重的环境问题,将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。下图是通过人工光合作用,以![]() 和
和![]() 为原料制备HCOOH和
为原料制备HCOOH和![]() 的原理示意图。电极b表面的电极反应式为________。
的原理示意图。电极b表面的电极反应式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg![]() 的变化如图所示,下列叙述错误的是 ( )
的变化如图所示,下列叙述错误的是 ( )
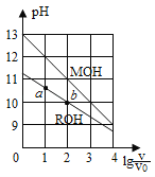
A.当lg![]() = 2时,若两溶液同时升高温度,则
= 2时,若两溶液同时升高温度,则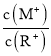 增大
增大
B.MOH的碱性强于ROH的碱性
C.ROH的电离程度:b点大于a点
D.两溶液分别与盐酸反应完全,则消耗HCl的物质的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:常温下,pKa(HNO2)=-lgKa(HNO2)=3.37。在体积均为20mL、浓度均为0.1mol/L的HNO3溶液、HNO2溶液中滴加同浓度的NaOH溶液,溶液的导电离与NaOH溶液体积关系如图所示。下列说法错误的是
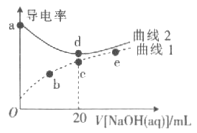
A.曲线1代表HNO2溶液
B.常温下,c、d点溶液的pH都为7
C.加水稀释b点溶液,水的电离程度增大
D.常温下,a、e点溶液中Kw相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com