
【题目】化合物M是一种常用的液晶材料。以苯的同系物A、G为原料合成M的一种路线(部分反应条件略去)如下:

已知:![]() +
+![]() , 回答下列问题:
, 回答下列问题:
(1)M的结构简式为________ ,A的名称为___________。
(2)D中官能团的名称是________
(3)②的反应类型是_________,⑥的反应类型是___________。
(4)⑤的化学方程式为_______________。
(5)满足以下条件的B的同分异构体有_______________种(不考虑立体异构)。
①能与氯化铁溶液发生显色反应;②苯环上只有两个取代基;③除苯环以外没有其它环状结构
(6)参照上述合成路线,设计一条由苯乙烯和甲苯为起始原料制备![]() 的合成路线:_______________
的合成路线:_______________
[示例:![]() ]
]
【答案】 ![]() 乙苯 碳碳双键 加成(还原)反应 取代反应
乙苯 碳碳双键 加成(还原)反应 取代反应 ![]() 24
24 
【解析】由B的结构可知反应①为取代反应,A为![]() ,B发生还原反应生成C,D能与溴的四氯化碳反应生成E,E在氢氧化钾、乙醇条件下反应得到F,可知E为卤代烃,D含有不饱和键,故反应③为消去反应,则D为
,B发生还原反应生成C,D能与溴的四氯化碳反应生成E,E在氢氧化钾、乙醇条件下反应得到F,可知E为卤代烃,D含有不饱和键,故反应③为消去反应,则D为![]() ,E为
,E为![]() ,F为
,F为![]() ,由M的分子式可知,反应⑦属于取代反应,M的结构简式为
,由M的分子式可知,反应⑦属于取代反应,M的结构简式为![]() ;
;
(1)M的结构简式为![]() ,
,![]() 的名称为乙苯;(2)
的名称为乙苯;(2)![]() 中官能团的名称是碳碳双键 ;
中官能团的名称是碳碳双键 ;
(3)反应②发生的羰基的加成反应,⑥是甲苯发生取代反应生成对碘甲苯;
(4)⑤的化学方程式为![]() ;
;
(5)①能与氯化铁溶液发生显色反应,说明含有酚羟基;②苯环上只有两个取代基,两取代基有邻、间、对三个位置;③除苯环以外没有其它环状结构;除酚羟基外,另一个取代基为—C4H7,其可能结构有—CH=CHCH2CH3、—CH2CH=CHCH3、—CH2CH2CH=CH2、—C(CH3)=CHCH3、—CH=CH(CH3)2、—CH2C(CH3)=CH2、—CH(CH3)CH=CH2、—C(CH2CH3)=CH2,共8种,再结合二个取代基的位置关系,则满足条件的![]() 同分异构体有3×8=24种。
同分异构体有3×8=24种。
(6)由苯乙烯和甲苯为起始原料制备![]() 的合成路线
的合成路线 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】金属铝在生产生活中有广泛用途。
(1)铝元素位于元素周期表中第_______周期、第________族。
(2)19Al 是铝的一种核素,其中子数是_______。
(3)铝热反应可用于焊接钢轨,下图为铝热反应的实验装置图。
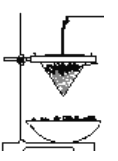
①该铝热反应的化学方程式是_______,该反应的现象是_______,此现象说明反应物的总能量_______生成物的总能量( 填“﹤ ” “﹥ ”“=”)。
②反应结束后,从沙中取出生成的固体物质,有同学推测该固体是铁铝合金,他设计了如下实验证明此固体中含有金属铝:取少量固体于试管中,滴加_______,当观察到_______现象时, 证明固体中含有金属铝。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化铈(CeO2)是一种主要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2以及其他少量可溶于稀酸的物质)。某课题组就此粉末为原料回收铈,设计实验流程如下:
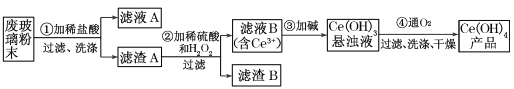
(1)洗涤滤渣A的目的是为了除去_____________(填离子符号),检验该离子是否洗净的方法是________________。
(2)第②步反应的离子方程式是___________________,滤渣B的主要成分是___________。
(3)萃取是分离稀士元素的常用方法,已知化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,TBP_______(填“能”或“不能”)与水互溶。实验室进行萃取操作时用到的主要玻璃仪器有___________、烧杯、玻璃棒、量筒等。
(4)取上述流程中得到的Ce(OH)4产品0.536 g,加硫酸溶解后,用0.1000 mol·L-1FeSO4标准溶液滴定至终点时(铈被还原为Ce3+),消耗25.00 mL标准维液,该产品中Ce(OH)4的质量分数为_______________(保留3位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有Cu2+、Fe2+、Mg2+、Cl-、NO3-,用石墨作电极进行电解时,肯定得不到的产物是
A. Cl2B. MgC. CuD. H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铋元素可表示为83Bi,在元素周期表中相对原子质量标示为209.0,下列说法正确的是( )
A. Bi元素的中子数是83
B. Bi元素最高价氧化物的化学式为Bi2O3
C. Bi原子最高价氧化物的水化物酸性比硝酸的要强
D. Bi元素位于元素周期表第六周期第ⅤA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于合金的叙述中正确的是( )
A. 日常生活中用到的五角硬币属于铜合金
B. 低碳钢比中碳钢强度高
C. 合金在任何情况都比单一金属性能优良
D. 合金是由两种或多种金属熔合而成的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究NH3的性质具有重要意义。请回答下列问题:
(1)已知:①NH3 (g)+3O2(g)=2N2(g)+6H2O(g) △H=-1266.5kJ·mol-1
②N2(g)+O2(g)=2NO(g) △H=+180.5 kJ·mol-1
写出氨高温催化氧化生成NO的热化学方程式___________。
(2)氨气、空气可以构成燃料电池,其电池反应原理为:4NH3+302=2N2+6H2O。已知电解质溶液为KOH溶液,则负极的电极反应式为________。
(3)合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的化学平衡常数K值和温度的关系如下:

由上表数据可知该反应的△H_______ 0 填“> ”、“< ”或“=”) ;
理论上,为了增大平衡时H2的转化率,可采取的措施是_______(选填字母);
A.增大压强 B.使用合适的催化剂 C.升高温度 D.及时分离出产物中的NH3
③400℃时,测得某时刻氨气、氮气、氢气的物质的量浓度分别为3mol·L-1、2 mol·L-1、l mol·L-1,此时刻该反应的V正(N2)=______ V逆(N2)。(填“>”、“<”或“=”)。
(4)已知25℃时,Ksp[Fe(OH)3]=1.0×l0-38, Ksp[Al(OH)3]=3.0×l0-34,当溶液中的金属离子浓度小于1.0×10-5mol·L-1时,可以认为沉淀完全。在含Fe3+、A13+的浓度均为1. 05mol·L-1的溶液中加入氨水,当Fe3+完全沉淀时,A13+沉淀的百分数____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种黑色粉末氧化铜、氧化亚铁、二氧化锰、石墨粉,只需加入一种试剂即可将它们区别开来, 这种试剂是( )
A. 氢氧化钠溶液 B. 稀硫酸
C. 浓盐酸 D. 蒸馏水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com