
【题目】运用化学反应原理研究NH3的性质具有重要意义。请回答下列问题:
(1)已知:①NH3 (g)+3O2(g)=2N2(g)+6H2O(g) △H=-1266.5kJ·mol-1
②N2(g)+O2(g)=2NO(g) △H=+180.5 kJ·mol-1
写出氨高温催化氧化生成NO的热化学方程式___________。
(2)氨气、空气可以构成燃料电池,其电池反应原理为:4NH3+302=2N2+6H2O。已知电解质溶液为KOH溶液,则负极的电极反应式为________。
(3)合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的化学平衡常数K值和温度的关系如下:

由上表数据可知该反应的△H_______ 0 填“> ”、“< ”或“=”) ;
理论上,为了增大平衡时H2的转化率,可采取的措施是_______(选填字母);
A.增大压强 B.使用合适的催化剂 C.升高温度 D.及时分离出产物中的NH3
③400℃时,测得某时刻氨气、氮气、氢气的物质的量浓度分别为3mol·L-1、2 mol·L-1、l mol·L-1,此时刻该反应的V正(N2)=______ V逆(N2)。(填“>”、“<”或“=”)。
(4)已知25℃时,Ksp[Fe(OH)3]=1.0×l0-38, Ksp[Al(OH)3]=3.0×l0-34,当溶液中的金属离子浓度小于1.0×10-5mol·L-1时,可以认为沉淀完全。在含Fe3+、A13+的浓度均为1. 05mol·L-1的溶液中加入氨水,当Fe3+完全沉淀时,A13+沉淀的百分数____________。
【答案】 4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-905.8kJ·mol-1 2 NH3+6OH--6e-=N2+6H2O < ad < 70%
【解析】(1)(1)已知:①4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1266.8kJ/mol,②N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol,利用盖斯定律①-2×②可得:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H=-905.8KJ/mol;
4NO(g)+6H2O(g) △H=-905.8KJ/mol;
(2)负极发生氧化反应,氨气被氧化生产氮气,电极反应式为2NH3-6e-+6OH-=N2+6H2O;
(3)图表中平衡常数随温度升高减小,说明平衡逆向进行,逆向是吸热反应,正向是放热反应;反应是N2+3H2![]() 2NH3,反应是气体体积减小的放热反应,为了增大平衡时H2的转化率,平衡正向进行分析;a.增大压强,平衡正向进行,氢气转化率增大,故a符合;b.使用合适的催化剂,改变反应速率,不能改变平衡,氢气转化率不变,故b不符合;c.升高温度平衡逆向进行,氢气转化率减小,故c不符合;d.及时分离出产物中的NH3,平衡正向进行,氢气转化率增大,故d符合;故答案为ad;
2NH3,反应是气体体积减小的放热反应,为了增大平衡时H2的转化率,平衡正向进行分析;a.增大压强,平衡正向进行,氢气转化率增大,故a符合;b.使用合适的催化剂,改变反应速率,不能改变平衡,氢气转化率不变,故b不符合;c.升高温度平衡逆向进行,氢气转化率减小,故c不符合;d.及时分离出产物中的NH3,平衡正向进行,氢气转化率增大,故d符合;故答案为ad;
③③Qc=![]() =4.5>K=0.5,说明反应向逆反应方向进行,因此v正(N2)<v逆(N2);
=4.5>K=0.5,说明反应向逆反应方向进行,因此v正(N2)<v逆(N2);
(4)当溶液中离子浓度小于1.0×10-5molL-1可以认为完全沉淀,Ksp=c(Fe3+)c3(OH-)=10-5×c3(OH-)=1×10-38,c(OH-)=![]() mol/L=10-11mol/L,Ksp[Al(OH)3]=c(Al3+)×c3(OH-)=3.0×l0-34,c(Al3+)=(3.0×l0-34)÷(10-11mol/L)3=0.3mol/L,A13+沉淀的百分数=
mol/L=10-11mol/L,Ksp[Al(OH)3]=c(Al3+)×c3(OH-)=3.0×l0-34,c(Al3+)=(3.0×l0-34)÷(10-11mol/L)3=0.3mol/L,A13+沉淀的百分数=![]() ×100%=70%。
×100%=70%。


科目:高中化学 来源: 题型:
【题目】(双选)将20mLNO2和NH3的混合气体,在一定条件下充分反应,化学方程式是:6NO2+8NH3![]() 7N2+12H2O。已知参加反应的NO2比NH3少2mL(气体体积均在相同状况下测定),则原混合气体中NO2和NH3的物质的量之比是
7N2+12H2O。已知参加反应的NO2比NH3少2mL(气体体积均在相同状况下测定),则原混合气体中NO2和NH3的物质的量之比是
A. 3∶2 B. 2∶3 C. 3∶7 D. 3∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M是一种常用的液晶材料。以苯的同系物A、G为原料合成M的一种路线(部分反应条件略去)如下:

已知:![]() +
+![]() , 回答下列问题:
, 回答下列问题:
(1)M的结构简式为________ ,A的名称为___________。
(2)D中官能团的名称是________
(3)②的反应类型是_________,⑥的反应类型是___________。
(4)⑤的化学方程式为_______________。
(5)满足以下条件的B的同分异构体有_______________种(不考虑立体异构)。
①能与氯化铁溶液发生显色反应;②苯环上只有两个取代基;③除苯环以外没有其它环状结构
(6)参照上述合成路线,设计一条由苯乙烯和甲苯为起始原料制备![]() 的合成路线:_______________
的合成路线:_______________
[示例:![]() ]
]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知硼、氮、钴、铜是几种重要的元素,请回答下列向题:
(1)Co的基态原子中未成对电子数为________个;Cu的基态原子的电子排布式为_______。
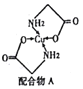
(2)Cu的配合物A的结构如右图,A中所含C、N、O三种元素的第一电离能由大到小的顺序为________。其中氮原子的杂化方式是_______________。
(3)配体氨基乙酸根(H2NCH2COO-)受热分解可产生CO2 和N2, N2中δ键和π键数目之比是________;N2O与CO2互为等电子体,结构相似,且N2O分子中O只与一个N相连,则N2O的电子式为________。
(4)立方氮化硼的晶胞结构与金刚石结构相似(如下图),是超硬材料。

①晶胞中每个氮原子周围与其最近且等距离的硼原子有________个;
②结构化学上常用原子坐标参数表示晶胞内部各原子的相对位置,立方氮化翻的晶胞中,B原子的坐标参数分别有:B (0,0,0);B(![]() ,0,
,0, ![]() );B (
);B (![]() ,(
,(![]() ,
, ![]() ,0)等,则距离上述三个B原子最近且等距离的N原子的坐标参数为_________;
,0)等,则距离上述三个B原子最近且等距离的N原子的坐标参数为_________;
③已知氮化硼晶胞边长为apm,则氮化硼的密度为_______g·cm -3(设NA为阿伏加德罗常数值,只要求列算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 含有共价键的化合物必是共价化合物
B. 阴、阳离子间通过静电引力所形成的化学键是离子键
C. 化学变化过程,一定会破坏旧的化学键,同时形成新的化学键
D. 液态氯化氢中存在H+和Cl-,所以能导电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
已知化合物Z(4 -乙酰氨基苯甲酸乙酯)是重要的化工中间体,其一种合成路径如下:
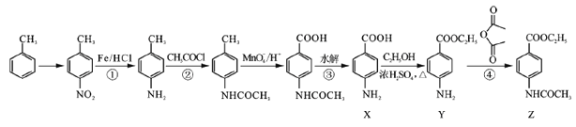
(1)反应①的反应类型为____________,Y中的含氧官能团名称为____________。
(2)合成路径中反应②、③的目的是_________________。
(3)试剂X可以脱水缩合为一种链状高分子化合物,其结构简式为__________________。
(4)写出反应④的化学方程式_____________________。
(5)Y是一种医用麻醉剂,其符合下列条件的同分异构体数目为________________种。
①苯环上有两个取代基,其中一个为氨基(—NH2)且与苯环直接相连;
②能发生水解反应。
写出其中能发生银镜反应且核磁共振氢谱中峰最少的同分异构体的结构简式_________________。
(6)某同学进一步优化了上述合成路线,发现经三步反应即可将![]() 转化成
转化成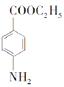 ,请写出该同学的合成路线(无机试剂任选)。________
,请写出该同学的合成路线(无机试剂任选)。________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙晶体﹝CaO2·8H2O﹞较稳定,呈白色,微溶于水,广泛应用于环境杀菌、消毒, 也在食品、牙膏、化妆品等制造中用作添加剂,还可以作为鱼池增氧剂。现以贝壳为原料制备CaO2流程如下:
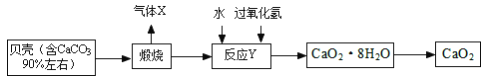
(1)将过氧化钙晶体与溶液分离的方法是_____。
(2)我国制碱工业的先驱侯德榜先生为纯碱和氮肥工业技术的发展做出了杰出的贡献。其制备 原料有气体 X、氨气、精制饱和食盐水,过程主要是先制得小苏打,再过滤并加热分解小苏打制得纯碱。
①实验过程中应该先向精制饱和食盐水中通入_____,其原因是_____。
②请写出制备纯碱第一步发生的化学方程式_____。
(3)反应Y 不能在较高温度下进行的原因是_____; 已知该反应是化合反应,则反应 Y 的化学方程式是___________________;获得的过氧化钙晶体中常含有 Ca(OH)2 杂质,原因是_________。
(4)现设计如下实验测定制得的过氧化钙晶体[CaO2·8H2O]中 CaO2 的质量分数:称取晶体样品25 g,加热到 220℃充分分解,其产物含有参与反应 Y 的固体物质和能使带火星木条复燃的气体等(此时所得气体混合物的总质量为1.6 g)(已知杂质不发生变化),则该晶体样品中 CaO2 的质量分数是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与社会、生活密切相关,下列说法正确的是
A. 通过浸渍水玻璃的方法防止木材腐朽
B. 宣纸的主要成分为蛋白质,酸性条件下易水解
C. 地沟油的主要成分与柴油的主要成分相同,所以地沟油可用于制生物柴油
D. SO2有毒,不能用作食品漂白剂和食品防腐剂添加在粉条、红酒等食品饮料中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com