
【题目】
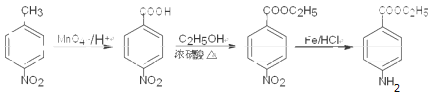
已知化合物Z(4 -乙酰氨基苯甲酸乙酯)是重要的化工中间体,其一种合成路径如下:
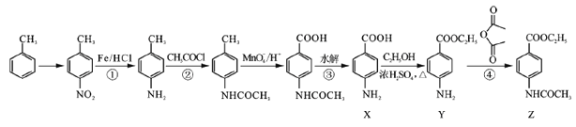
(1)反应①的反应类型为____________,Y中的含氧官能团名称为____________。
(2)合成路径中反应②、③的目的是_________________。
(3)试剂X可以脱水缩合为一种链状高分子化合物,其结构简式为__________________。
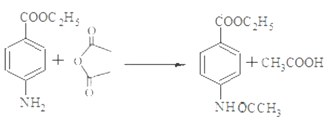
(4)写出反应④的化学方程式_____________________。
(5)Y是一种医用麻醉剂,其符合下列条件的同分异构体数目为________________种。
①苯环上有两个取代基,其中一个为氨基(—NH2)且与苯环直接相连;
②能发生水解反应。
写出其中能发生银镜反应且核磁共振氢谱中峰最少的同分异构体的结构简式_________________。
(6)某同学进一步优化了上述合成路线,发现经三步反应即可将![]() 转化成
转化成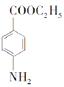 ,请写出该同学的合成路线(无机试剂任选)。________
,请写出该同学的合成路线(无机试剂任选)。________
【答案】 还原反应 酯基 保护氨基,不被酸性高锰酸钾溶液氧化 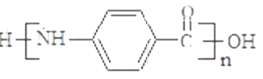
 17
17 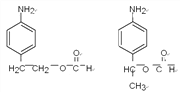
【解析】(1)反应①是甲苯的硝化反应,反应类型为取代反应;根据Y的结构简式可知Y中的含氧官能团名称为酯基。(2)由于氨基易被氧化,为了防止氧化甲基时氨基被氧化,合成路径中反应②、③的目的是保护氨基,不被酸性高锰酸钾溶液氧化。(3)试剂X中含有氨基和羧基,可以脱水缩合为一种链状高分子化合物,其结构简式为![]() 。(4)反应④是氨基上的氢原子被取代,反应的化学方程式为
。(4)反应④是氨基上的氢原子被取代,反应的化学方程式为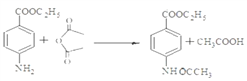 。(5) ①苯环上有两个取代基,其中一个为氨基(—NH2)且与苯环直接相连;②能发生水解反应,说明含有酯基,则酯基可以是-OOCCH2CH3或-CH2OOCCH3或-CH2CH2OOCH或-CH(CH3)OOCH或-COOCH2CH3或-CH2COOCH3,均有邻间对三种,除去Y以外还有17种;其中能发生银镜反应且核磁共振氢谱中峰最少的同分异构体的结构简式为
。(5) ①苯环上有两个取代基,其中一个为氨基(—NH2)且与苯环直接相连;②能发生水解反应,说明含有酯基,则酯基可以是-OOCCH2CH3或-CH2OOCCH3或-CH2CH2OOCH或-CH(CH3)OOCH或-COOCH2CH3或-CH2COOCH3,均有邻间对三种,除去Y以外还有17种;其中能发生银镜反应且核磁共振氢谱中峰最少的同分异构体的结构简式为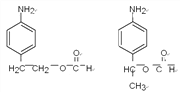 。(6)可以首先氧化甲基,然后酯化,最后还原硝基为氨基,即
。(6)可以首先氧化甲基,然后酯化,最后还原硝基为氨基,即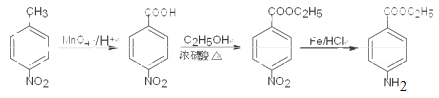 。
。


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】下列关于合金的叙述中正确的是( )
A. 日常生活中用到的五角硬币属于铜合金
B. 低碳钢比中碳钢强度高
C. 合金在任何情况都比单一金属性能优良
D. 合金是由两种或多种金属熔合而成的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究NH3的性质具有重要意义。请回答下列问题:
(1)已知:①NH3 (g)+3O2(g)=2N2(g)+6H2O(g) △H=-1266.5kJ·mol-1
②N2(g)+O2(g)=2NO(g) △H=+180.5 kJ·mol-1
写出氨高温催化氧化生成NO的热化学方程式___________。
(2)氨气、空气可以构成燃料电池,其电池反应原理为:4NH3+302=2N2+6H2O。已知电解质溶液为KOH溶液,则负极的电极反应式为________。
(3)合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的化学平衡常数K值和温度的关系如下:

由上表数据可知该反应的△H_______ 0 填“> ”、“< ”或“=”) ;
理论上,为了增大平衡时H2的转化率,可采取的措施是_______(选填字母);
A.增大压强 B.使用合适的催化剂 C.升高温度 D.及时分离出产物中的NH3
③400℃时,测得某时刻氨气、氮气、氢气的物质的量浓度分别为3mol·L-1、2 mol·L-1、l mol·L-1,此时刻该反应的V正(N2)=______ V逆(N2)。(填“>”、“<”或“=”)。
(4)已知25℃时,Ksp[Fe(OH)3]=1.0×l0-38, Ksp[Al(OH)3]=3.0×l0-34,当溶液中的金属离子浓度小于1.0×10-5mol·L-1时,可以认为沉淀完全。在含Fe3+、A13+的浓度均为1. 05mol·L-1的溶液中加入氨水,当Fe3+完全沉淀时,A13+沉淀的百分数____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和S![]() 可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是 ( )
可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是 ( )
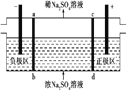
A. 通电后中间隔室的S![]() 离子向正极迁移,正极区溶液pH增大
离子向正极迁移,正极区溶液pH增大
B. 当电路中通过1 mol电子的电量时,会有0.5 mol的O2生成
C. 负极反应为2H2O-4e-![]() O2+4H+,负极区溶液pH降低
O2+4H+,负极区溶液pH降低
D. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】熟石灰在生产和生活中有广泛的用途。请回答:
(1)熟石灰中金属元素的原子结构示意图是_____。
(2)区分熟石灰溶液、氯化钠溶液、稀硫酸的操作及现象是__________。
(3)用石灰浆粉刷墙壁,干燥后墙面变硬,反应的化学方程式是_____。
(4)某地区土壤呈酸性(含硫酸),可选用熟石灰来改良,则反应的化学方程式是_________。
(5)用熟石灰粉与草木灰按一定比例混合可制得高效环保农药“黑白粉”。使用时,选择在有露 水的早晨,把“黑白粉”撒在植物茎叶上,可消除忌碱虫体。
①“黑白粉”比熟石灰更高效,是由于生成了碱性更强的物质,该反应的化学方程式是________。
②“黑白粉”中可提供植物生长和抗倒伏的营养元素是_____(填元素符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种黑色粉末氧化铜、氧化亚铁、二氧化锰、石墨粉,只需加入一种试剂即可将它们区别开来, 这种试剂是( )
A. 氢氧化钠溶液 B. 稀硫酸
C. 浓盐酸 D. 蒸馏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硅酸的说法正确的是( )
A. 硅酸是一种不溶于水的含氧酸 B. 硅酸不溶于水,是一种非电解质
C. 硅酸的酸性比碳酸强 D. 硅酸可由二氧化硅与水反应制得
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com