
【题目】过氧化钙晶体﹝CaO2·8H2O﹞较稳定,呈白色,微溶于水,广泛应用于环境杀菌、消毒, 也在食品、牙膏、化妆品等制造中用作添加剂,还可以作为鱼池增氧剂。现以贝壳为原料制备CaO2流程如下:
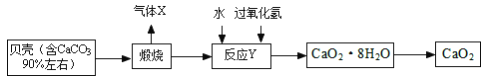
(1)将过氧化钙晶体与溶液分离的方法是_____。
(2)我国制碱工业的先驱侯德榜先生为纯碱和氮肥工业技术的发展做出了杰出的贡献。其制备 原料有气体 X、氨气、精制饱和食盐水,过程主要是先制得小苏打,再过滤并加热分解小苏打制得纯碱。
①实验过程中应该先向精制饱和食盐水中通入_____,其原因是_____。
②请写出制备纯碱第一步发生的化学方程式_____。
(3)反应Y 不能在较高温度下进行的原因是_____; 已知该反应是化合反应,则反应 Y 的化学方程式是___________________;获得的过氧化钙晶体中常含有 Ca(OH)2 杂质,原因是_________。
(4)现设计如下实验测定制得的过氧化钙晶体[CaO2·8H2O]中 CaO2 的质量分数:称取晶体样品25 g,加热到 220℃充分分解,其产物含有参与反应 Y 的固体物质和能使带火星木条复燃的气体等(此时所得气体混合物的总质量为1.6 g)(已知杂质不发生变化),则该晶体样品中 CaO2 的质量分数是_____。
【答案】 过滤 氨气 氨气的溶解度大,二氧化碳溶解度小,先通入氨气使得溶液呈碱性,可以吸收更多的二氧化碳,从而制得更多的产品 NaCl+CO2+NH3+H2O=NH4Cl+NaHCO3↓ 防止过氧化氢受热分解 CaO+H2O2+7H2O=CaO2·8H2O CaO 或 Ca(OH)2过量,且 Ca(OH)2微溶 28.8%
【解析】(1)分离固体与液体采用过滤的方法;故答案为:过滤;
(2)①氨气的溶解度大,二氧化碳溶解度小,先通入氨气使得溶液呈碱性,可以吸收更多的二氧化碳,从而制得更多的产品,故答案为:氨气;氨气的溶解度大,二氧化碳溶解度小,先通入氨气使得溶液呈碱性,可以吸收更多的二氧化碳,从而制得更多的产品;
②反应物是氯化钠溶液、氨气、二氧化碳,生成物中析出碳酸氢钠晶体,然后根据质量守恒定律写出化学反应式配平即可,方程式为:NaCl+CO2+NH3+H2O=NH4Cl+NaHCO3↓,故答案为:NaCl+CO2+NH3+H2O=NH4Cl+NaHCO3↓;
(3)该反应的反应物是氧化钙、水和过氧化氢,因为过氧化氢受热分解,反应 Y 不能在较高温度下进行;控制温度在0~5℃,可以在冰水混合物中进行;该反应的反应物是氧化钙、水和过氧化氢,生成物是CaO28H2O,因为氧化钙能与水反应生成氢氧化钙,而氢氧化钙微溶于水;故答案为:防止过氧化氢受热分解;CaO+H2O2+7H2O=CaO28H2O;CaO或Ca(OH)2过量,且Ca(OH)2微溶;
(4)根据同一反应的方程式为2CaO2![]() 2CaO+O2↑。设样品中CaO28H2O的质量为x
2CaO+O2↑。设样品中CaO28H2O的质量为x
2CaO2![]() 2CaO+O2↑
2CaO+O2↑
144 32
x 16g
![]() =
=![]() ,x=7.2g,则样品中CaO28H2O的质量分数为
,x=7.2g,则样品中CaO28H2O的质量分数为![]() ×100%=28.8%,答:样品中CaO28H2O的质量分数为28.8%。
×100%=28.8%,答:样品中CaO28H2O的质量分数为28.8%。


科目:高中化学 来源: 题型:
【题目】二氧化铈(CeO2)是一种主要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2以及其他少量可溶于稀酸的物质)。某课题组就此粉末为原料回收铈,设计实验流程如下:
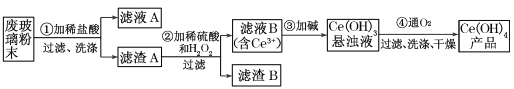
(1)洗涤滤渣A的目的是为了除去_____________(填离子符号),检验该离子是否洗净的方法是________________。
(2)第②步反应的离子方程式是___________________,滤渣B的主要成分是___________。
(3)萃取是分离稀士元素的常用方法,已知化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,TBP_______(填“能”或“不能”)与水互溶。实验室进行萃取操作时用到的主要玻璃仪器有___________、烧杯、玻璃棒、量筒等。
(4)取上述流程中得到的Ce(OH)4产品0.536 g,加硫酸溶解后,用0.1000 mol·L-1FeSO4标准溶液滴定至终点时(铈被还原为Ce3+),消耗25.00 mL标准维液,该产品中Ce(OH)4的质量分数为_______________(保留3位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究NH3的性质具有重要意义。请回答下列问题:
(1)已知:①NH3 (g)+3O2(g)=2N2(g)+6H2O(g) △H=-1266.5kJ·mol-1
②N2(g)+O2(g)=2NO(g) △H=+180.5 kJ·mol-1
写出氨高温催化氧化生成NO的热化学方程式___________。
(2)氨气、空气可以构成燃料电池,其电池反应原理为:4NH3+302=2N2+6H2O。已知电解质溶液为KOH溶液,则负极的电极反应式为________。
(3)合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的化学平衡常数K值和温度的关系如下:

由上表数据可知该反应的△H_______ 0 填“> ”、“< ”或“=”) ;
理论上,为了增大平衡时H2的转化率,可采取的措施是_______(选填字母);
A.增大压强 B.使用合适的催化剂 C.升高温度 D.及时分离出产物中的NH3
③400℃时,测得某时刻氨气、氮气、氢气的物质的量浓度分别为3mol·L-1、2 mol·L-1、l mol·L-1,此时刻该反应的V正(N2)=______ V逆(N2)。(填“>”、“<”或“=”)。
(4)已知25℃时,Ksp[Fe(OH)3]=1.0×l0-38, Ksp[Al(OH)3]=3.0×l0-34,当溶液中的金属离子浓度小于1.0×10-5mol·L-1时,可以认为沉淀完全。在含Fe3+、A13+的浓度均为1. 05mol·L-1的溶液中加入氨水,当Fe3+完全沉淀时,A13+沉淀的百分数____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】熟石灰在生产和生活中有广泛的用途。请回答:
(1)熟石灰中金属元素的原子结构示意图是_____。
(2)区分熟石灰溶液、氯化钠溶液、稀硫酸的操作及现象是__________。
(3)用石灰浆粉刷墙壁,干燥后墙面变硬,反应的化学方程式是_____。
(4)某地区土壤呈酸性(含硫酸),可选用熟石灰来改良,则反应的化学方程式是_________。
(5)用熟石灰粉与草木灰按一定比例混合可制得高效环保农药“黑白粉”。使用时,选择在有露 水的早晨,把“黑白粉”撒在植物茎叶上,可消除忌碱虫体。
①“黑白粉”比熟石灰更高效,是由于生成了碱性更强的物质,该反应的化学方程式是________。
②“黑白粉”中可提供植物生长和抗倒伏的营养元素是_____(填元素符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“家庭小实验”是利用家庭生活中常见的物质,进行化学实验探究活动,下列实验不能用“家庭小实验”完成的是( )
A. 检验自来水中是否含有氯离子B. 用闻气味的方法鉴别酒精和水
C. 检验食盐和纯碱D. 探究铁在潮湿的空气中是否生锈
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种黑色粉末氧化铜、氧化亚铁、二氧化锰、石墨粉,只需加入一种试剂即可将它们区别开来, 这种试剂是( )
A. 氢氧化钠溶液 B. 稀硫酸
C. 浓盐酸 D. 蒸馏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.1 mol·L-1NaOH溶液分别滴定体积均为20mL、浓度均为0.1 mol·L-1HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积关系如图(P为曲线I上的点,M、N为曲线II上的点),下列说法不正确的是
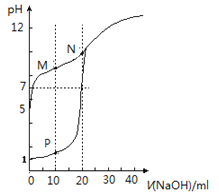
A. HX为弱酸
B. 将P点和N点的溶液混合,所得溶液呈酸性
C. M 点 c(HX)-c(X-)>c(OH-)-c(H+)
D. 向 N点溶液中通入HCl至 PH = 7:c(Na+)>c(HX)=c(Cl-)>c(X-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO、NO2 和CO均为大气污染物,对其治理备受关注。请回答下列问题:
I.碱液吸收法
(1)NaOH溶液可将NO和NO2的混合气体转化为NaNO2,该反应的离子方程式为_________________________________________。
(2)25℃时,HNO2的电离常数Ka=4.6×10-4。常温下,向NaNO2溶液中滴加盐酸至溶液的pH=3时,溶液中![]() =_________(保留两位有效数字)
=_________(保留两位有效数字)
Ⅱ.已知综合治理NO和CO的原理为
i. 2NO(g)+2CO(g)![]() N2(g)+2CO2 (g) △H=-746.5kJmol-1
N2(g)+2CO2 (g) △H=-746.5kJmol-1
ii. C(s)+ 2NO(g)![]() N2(g)+ CO2 (g) △H= +172.5 kJmol-1
N2(g)+ CO2 (g) △H= +172.5 kJmol-1
(3)高温下,1mol C(s)与CO2 完全反应生成CO的热化学方程式为________________________。
(4)一定条件下,某密闭容器中发生反应i和反应ii。达到平衡后,其他条件不变,升高温度,CO的体积分数_______(填“增大”“ 减小”或“无影响”)。
(5)一定条件下,恒容密闭容器中发生反应i。若起始充入的![]() =y,NO的平衡转化率(a)与y和温度(T)的关系如图所示。
=y,NO的平衡转化率(a)与y和温度(T)的关系如图所示。

①y1_____y2(填“>”“<”或“=”)
②M点和N点对应的该反应速率:M_________N(填“>”“<”或“=”)
(6)t℃时,向容积为10L的恒压密闭容器中加入1mol C(s)和2molNO(g),发生反应ii。5min达到平衡时,测得0~5min内,用CO2表示的该反应速率v(CO2)=0.016 molL-1·min-1;N2的体积分数为a。则:
①t℃时,该反应的平衡常数K=_____________。
②若保持条件不变,起始向该容器中按下列配比加入物质,达到平衡时,N2的体积分数仍为a的是____________________(填选项字母)
A.0.5molC和2mol NO B.2mol N2和2mol CO2
C.1 mol C、1 mol N2和1mol CO2 D.1 mol C、1 mol NO和1mol N2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com