
【题目】NO、NO2 和CO均为大气污染物,对其治理备受关注。请回答下列问题:
I.碱液吸收法
(1)NaOH溶液可将NO和NO2的混合气体转化为NaNO2,该反应的离子方程式为_________________________________________。
(2)25℃时,HNO2的电离常数Ka=4.6×10-4。常温下,向NaNO2溶液中滴加盐酸至溶液的pH=3时,溶液中![]() =_________(保留两位有效数字)
=_________(保留两位有效数字)
Ⅱ.已知综合治理NO和CO的原理为
i. 2NO(g)+2CO(g)![]() N2(g)+2CO2 (g) △H=-746.5kJmol-1
N2(g)+2CO2 (g) △H=-746.5kJmol-1
ii. C(s)+ 2NO(g)![]() N2(g)+ CO2 (g) △H= +172.5 kJmol-1
N2(g)+ CO2 (g) △H= +172.5 kJmol-1
(3)高温下,1mol C(s)与CO2 完全反应生成CO的热化学方程式为________________________。
(4)一定条件下,某密闭容器中发生反应i和反应ii。达到平衡后,其他条件不变,升高温度,CO的体积分数_______(填“增大”“ 减小”或“无影响”)。
(5)一定条件下,恒容密闭容器中发生反应i。若起始充入的![]() =y,NO的平衡转化率(a)与y和温度(T)的关系如图所示。
=y,NO的平衡转化率(a)与y和温度(T)的关系如图所示。

①y1_____y2(填“>”“<”或“=”)
②M点和N点对应的该反应速率:M_________N(填“>”“<”或“=”)
(6)t℃时,向容积为10L的恒压密闭容器中加入1mol C(s)和2molNO(g),发生反应ii。5min达到平衡时,测得0~5min内,用CO2表示的该反应速率v(CO2)=0.016 molL-1·min-1;N2的体积分数为a。则:
①t℃时,该反应的平衡常数K=_____________。
②若保持条件不变,起始向该容器中按下列配比加入物质,达到平衡时,N2的体积分数仍为a的是____________________(填选项字母)
A.0.5molC和2mol NO B.2mol N2和2mol CO2
C.1 mol C、1 mol N2和1mol CO2 D.1 mol C、1 mol NO和1mol N2
【答案】 NO+NO2+2OH-=2NO2-+H2O 2.2 C(s)+CO2(g)![]() 2CO(g) △H=+919.0kJ·mol-1 增大 > > 4 BC
2CO(g) △H=+919.0kJ·mol-1 增大 > > 4 BC
【解析】I.(1)NaOH溶液可将NO和NO2的混合气体转化为NaNO2,该反应的离子方程式为NO+NO2+2OH-=2NO2-+H2O,故答案为:NO+NO2+2OH-=2NO2-+H2O;
(2)25℃时,HNO2的电离常数Ka=4.6×10-4。常温下,向NaNO2溶液中滴加盐酸至溶液的pH=3时,溶液中![]() =
=![]() =
=![]() =
=![]() =2.2,故答案为:2.2;
=2.2,故答案为:2.2;
Ⅱ.(3)i. 2NO(g)+2CO(g)![]() N2(g)+2CO2 (g) △H=-746.5kJmol-1
N2(g)+2CO2 (g) △H=-746.5kJmol-1
ii. C(s)+ 2NO(g)![]() N2(g)+ CO2 (g) △H= +172.5 kJmol-1
N2(g)+ CO2 (g) △H= +172.5 kJmol-1
根据盖斯定律,将ii-i得:C(s)+CO2(g)![]() 2CO(g) △H=(+172.5 kJmol-1)-(-746.5kJmol-1)=+919.0KJ·mol-1,故答案为:C(s)+CO2(g)
2CO(g) △H=(+172.5 kJmol-1)-(-746.5kJmol-1)=+919.0KJ·mol-1,故答案为:C(s)+CO2(g)![]() 2CO(g) △H=+919.0KJ·mol-1;
2CO(g) △H=+919.0KJ·mol-1;
(4)一定条件下,某密闭容器中发生反应i和反应ii。达到平衡后,其他条件不变,升高温度,反应i逆向移动,CO的体积分数增大,故答案为:增大;
(5)①根据2NO(g)+2CO(g)![]() N2(g)+2CO2 (g),相同温度条件下,
N2(g)+2CO2 (g),相同温度条件下,![]() =y,增大y,表示增大CO的含量,NO的转化率越大,平衡时NO的体积分数越小,根据图像,y1>y2,故答案为:>;
=y,增大y,表示增大CO的含量,NO的转化率越大,平衡时NO的体积分数越小,根据图像,y1>y2,故答案为:>;
②M点和N点表示y不变时,升高温度,反应速率加快,对应的该反应速率:M>N,故答案为:>;
(6)t℃时,向容积为10L的恒压密闭容器中加入1mol C(s)和2molNO(g),发生反应ii。5min达到平衡时,测得0~5min内,用CO2表示的该反应速率v(CO2)=0.016 molL-1·min-1;N2的体积分数为a。则:
①t℃时,用CO2表示的该反应速率v(CO2)=0.016 molL-1·min-1;则c(CO2)= 0.016 molL-1·min-1×5min=0.08 mol/L,根据C(s)+ 2NO(g)![]() N2(g)+ CO2 (g),c(N2)= 0.08 mol/L,c(NO)=0.2 mol/L -0.16 mol/L=0.04 mol/L,该反应的平衡常数K=
N2(g)+ CO2 (g),c(N2)= 0.08 mol/L,c(NO)=0.2 mol/L -0.16 mol/L=0.04 mol/L,该反应的平衡常数K=![]() =
=![]() =4,故答案为:4;
=4,故答案为:4;
②反应C(s)+ 2NO(g)![]() N2(g)+ CO2 (g)属于气体的物质的量不变的反应,若保持条件不变,起始向该容器中按下列配比加入物质,达到平衡时,N2的体积分数仍为a,则按化学计量数转化到一边,满足对应物质的物质的量之比相同,为等效平衡。A. 由于碳是固体,平衡使反应的碳为0.8mol,则0.5molC不能满足平衡需要的量,故A错误; B. 2mol N2和2mol CO2与1mol C(s)和2molNO(g)等效,故B正确;C.碳为固体,1 mol N2和1mol CO2与2mol N2和2mol CO2的物质的量之比相等,与原平衡等效,故C正确;D. 1 mol C、1 mol NO和1mol N2相当于1.5mol N2和0.5mol CO2,物质的量之比不等于1:1,与原平衡不等效,故D错误;故选BC。
N2(g)+ CO2 (g)属于气体的物质的量不变的反应,若保持条件不变,起始向该容器中按下列配比加入物质,达到平衡时,N2的体积分数仍为a,则按化学计量数转化到一边,满足对应物质的物质的量之比相同,为等效平衡。A. 由于碳是固体,平衡使反应的碳为0.8mol,则0.5molC不能满足平衡需要的量,故A错误; B. 2mol N2和2mol CO2与1mol C(s)和2molNO(g)等效,故B正确;C.碳为固体,1 mol N2和1mol CO2与2mol N2和2mol CO2的物质的量之比相等,与原平衡等效,故C正确;D. 1 mol C、1 mol NO和1mol N2相当于1.5mol N2和0.5mol CO2,物质的量之比不等于1:1,与原平衡不等效,故D错误;故选BC。


科目:高中化学 来源: 题型:
【题目】过氧化钙晶体﹝CaO2·8H2O﹞较稳定,呈白色,微溶于水,广泛应用于环境杀菌、消毒, 也在食品、牙膏、化妆品等制造中用作添加剂,还可以作为鱼池增氧剂。现以贝壳为原料制备CaO2流程如下:
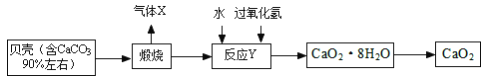
(1)将过氧化钙晶体与溶液分离的方法是_____。
(2)我国制碱工业的先驱侯德榜先生为纯碱和氮肥工业技术的发展做出了杰出的贡献。其制备 原料有气体 X、氨气、精制饱和食盐水,过程主要是先制得小苏打,再过滤并加热分解小苏打制得纯碱。
①实验过程中应该先向精制饱和食盐水中通入_____,其原因是_____。
②请写出制备纯碱第一步发生的化学方程式_____。
(3)反应Y 不能在较高温度下进行的原因是_____; 已知该反应是化合反应,则反应 Y 的化学方程式是___________________;获得的过氧化钙晶体中常含有 Ca(OH)2 杂质,原因是_________。
(4)现设计如下实验测定制得的过氧化钙晶体[CaO2·8H2O]中 CaO2 的质量分数:称取晶体样品25 g,加热到 220℃充分分解,其产物含有参与反应 Y 的固体物质和能使带火星木条复燃的气体等(此时所得气体混合物的总质量为1.6 g)(已知杂质不发生变化),则该晶体样品中 CaO2 的质量分数是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与社会、生活密切相关,下列说法正确的是
A. 通过浸渍水玻璃的方法防止木材腐朽
B. 宣纸的主要成分为蛋白质,酸性条件下易水解
C. 地沟油的主要成分与柴油的主要成分相同,所以地沟油可用于制生物柴油
D. SO2有毒,不能用作食品漂白剂和食品防腐剂添加在粉条、红酒等食品饮料中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 利用石油为原料制得的纤维是人造纤维
B. 天然纤维是不能再被加工处理的
C. 合成纤维、人造纤维和天然纤维统称化学纤维
D. 煤化工产品也可经过处理制得合成纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关。下列叙述正确的是( )
A. 煤的干馏和石油的分馏均属于化学变化
B. 蛋白质和蔗糖都属于高分子化合物,一定条件下都能水解
C. 乙烯的产量是衡量一个国家的石油化工发展水平的标志
D. 淀粉与纤维素互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将190 g MgCl2溶于水配制成1 L溶液。
(1)该溶液中MgCl2的物质的量浓度为________,溶液中Cl的物质的量浓度为________。
(2)配制1 mol/L的MgCl2溶液500 mL,需该溶液的体积为________。
(3)向(2)中500 mL溶液中再通入一定量的HCl气体后,溶液中Cl的浓度为3 mol·L1(假设溶液体积不变),则溶液中H+的物质的量浓度为_____, 通入HCl气体的体积(标况下)为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组通过灼烧法测定CuxSy的组成,并验证气体产物SO2的部分性质,设计实验如下(夹持装置略去):
I.测定CuxSy的组成

步骤一:用上图所示装置高温灼烧16.0gCuxSy至固体质量不再变化,停止加热,继续通入O2至硬质玻璃管冷却。
步骤二:向装置D所得溶液中加入足量双氧水,再加入过量BaCl2溶液;将生成的沉淀过滤、洗涤、干燥、称量得沉淀质量为23.3 g。
(1)装置C中用于加热的仪器名称为___________________。
(2)步骤一中,停止加热后,继续通入O2的主要作用为___________________。
(3)由实验数据推断得CuxSy的化学式为___________________。
(4)若无装置E,则所测x∶y的值 ________(填“偏大”“ 偏小”或“无影响”)。.
Ⅱ.该小组选用实验I中的装置A、B、C和下图所示装置,依次验证SO2的漂白性,氧化性和还原性。

(5)按气流方向,装置的合理连接顺序为A→B→C→______________(填装置字母)。
(6)试剂X的名称为_____________。能证明SO2有还原性的实验现象为______________。
(7)装置G中发生反应的离子方程式为________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com