
【题目】室温下,用0.1 mol·L-1NaOH溶液分别滴定体积均为20mL、浓度均为0.1 mol·L-1HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积关系如图(P为曲线I上的点,M、N为曲线II上的点),下列说法不正确的是
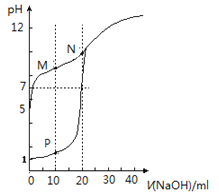
A. HX为弱酸
B. 将P点和N点的溶液混合,所得溶液呈酸性
C. M 点 c(HX)-c(X-)>c(OH-)-c(H+)
D. 向 N点溶液中通入HCl至 PH = 7:c(Na+)>c(HX)=c(Cl-)>c(X-)
【答案】B
【解析】A.未滴定时,0.1molL-1HCl溶液pH为1,由图可知0.1mol/L HX溶液的pH>5,则HX弱酸,故A正确;B.P点溶液中NaCl、HCl物质的量相等,N点为NaX溶液,NaX物质的量为HCl的2倍,混合后为NaCl、NaX、HX混合溶液,且溶液中NaX与HX的浓度相等,由于X-的水解程度大于HX的电离程度,呈碱性,故B错误;C.M点为等浓度NaX、HX混合溶液,且溶液呈碱性,说明X-的水解程度大于HX的电离程度,由物料守恒可知:2c(Na+)=c(X-)+c(HX),结合电荷守恒c(Na+)+c(H+)=c(X-)+c(OH-),联立可得:c(X-)+c(HX)+2c(H+)=2c(X-)+2c(OH-),整理得:c(HX)-c(X-)=2c(OH-)-2c(H+)>c(OH-)-c(H+),故C正确;D.根据电荷守恒:c(Na+)+c(H+)=c(Cl-)+c(X-)+c(OH-),溶液pH=7,则c(Na+)=c(Cl-)+c(X-),由物料守恒可知c(Na+)=c(X-)+c(HX),联立可得c(HX)=c(Cl-),而溶液为NaCl、NaX、HX的混合溶液,相同浓度下X-的水解程度大于HX的电离程度,由于溶液为中性,则溶液中c(NaX)<c(HX),故溶液中c(Na+)>c(HX)=c(Cl-)>c(X-),故D正确;故选B。


科目:高中化学 来源: 题型:
【题目】过氧化钙晶体﹝CaO2·8H2O﹞较稳定,呈白色,微溶于水,广泛应用于环境杀菌、消毒, 也在食品、牙膏、化妆品等制造中用作添加剂,还可以作为鱼池增氧剂。现以贝壳为原料制备CaO2流程如下:
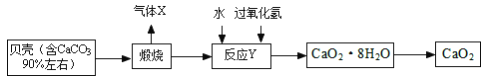
(1)将过氧化钙晶体与溶液分离的方法是_____。
(2)我国制碱工业的先驱侯德榜先生为纯碱和氮肥工业技术的发展做出了杰出的贡献。其制备 原料有气体 X、氨气、精制饱和食盐水,过程主要是先制得小苏打,再过滤并加热分解小苏打制得纯碱。
①实验过程中应该先向精制饱和食盐水中通入_____,其原因是_____。
②请写出制备纯碱第一步发生的化学方程式_____。
(3)反应Y 不能在较高温度下进行的原因是_____; 已知该反应是化合反应,则反应 Y 的化学方程式是___________________;获得的过氧化钙晶体中常含有 Ca(OH)2 杂质,原因是_________。
(4)现设计如下实验测定制得的过氧化钙晶体[CaO2·8H2O]中 CaO2 的质量分数:称取晶体样品25 g,加热到 220℃充分分解,其产物含有参与反应 Y 的固体物质和能使带火星木条复燃的气体等(此时所得气体混合物的总质量为1.6 g)(已知杂质不发生变化),则该晶体样品中 CaO2 的质量分数是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物的性质与其结构有着密切关系。苯有如下性质:
①苯与溴的四氯化碳溶液不反应;
②苯与酸性高锰酸钾溶液不反应;
③1mol苯在一定条件下可与3mol氢气发生加成反应
由此推断苯分子中6个碳原子之间的键是( )
A. 一种典型的单键
B. 一种典型的双键
C. 一种介于单键和双键之间独特的键
D. 极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列7种有机物
①CH4 ②![]() ③
③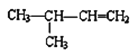 ④
④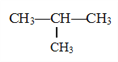
⑤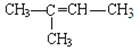 ⑥
⑥![]() ⑦
⑦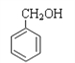
请回答:
(1)其中属于醇类的是________(填序号,下同),互为同系物的是_______,能与金属钠反应的有_________,互为同分异构体的是________。
(2)“辛烷值”用来表示汽油的质量,汽油中异辛烷的爆震程度最小,将其辛烷值标定为100。如图是异辛烷的模型,则异辛烷的系统命名为____________________。
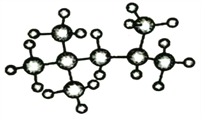
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组探究SO2的一些性质。
[探究一]:SO2能否被BaCl2溶液吸收。

甲、乙两同学分别设计如下装置甲和装置乙进行探究
甲、乙两同学实验时观察到各仪器中的现象如下:
A | B | C | D | |
装置甲中的现象 | Na2SO3固体表面有气泡.瓶中白雾 | 白色沉淀 | ----- | ------ |
装置乙中的现象 | Na2SO3固体表面有气泡.瓶中白雾 | 有气泡 | 有气泡 | 品红褪色 |
回答下列问题:
(1)甲同学经过后续实验确证了B中白色沉淀是BaSO4.甲同学的后续实验操作是____
(2)乙同学分析装置甲中产生BaSO4的可能原因有:
①A中产生的白雾是硫酸的酸雾,进入B中与BaCl2溶液反应生成BaSO4沉淀。
②________________________(用离子方程式表示)。
(3)装置乙中B中所盛试剂是___;乙同学在滴加浓硫酸之前的操作是___________
(4)通过上述实验,得出的结论是________________________
[探究二]:SO2与FeCl3溶液的反应
查阅资料:①Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+;②生成Fe(HSO3)2+离子的反应为可逆反应。实验步骤为:
步骤I | 往5mL1mol·L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色。微热3 min,溶液颜色变为浅绿色。 |
步骤II | 往5mL重新配制的1mol·L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色。几分钟后,发现溶液颜色变成浅绿色。 |
回答下列问题:
(5)当SO2通入到FeCl3(未用盐酸酸化)溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象。将混合液放置12小时,溶液才变成浅绿色。则溶液由棕黄色变成红棕色的原因是_________;写出溶液由红棕色变为浅绿色时发生反应的离子方程式___________
(6)通过实验可知_____和________可缩短浅绿色出现的时间。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与社会、生活密切相关,下列说法正确的是
A. 通过浸渍水玻璃的方法防止木材腐朽
B. 宣纸的主要成分为蛋白质,酸性条件下易水解
C. 地沟油的主要成分与柴油的主要成分相同,所以地沟油可用于制生物柴油
D. SO2有毒,不能用作食品漂白剂和食品防腐剂添加在粉条、红酒等食品饮料中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组通过灼烧法测定CuxSy的组成,并验证气体产物SO2的部分性质,设计实验如下(夹持装置略去):
I.测定CuxSy的组成

步骤一:用上图所示装置高温灼烧16.0gCuxSy至固体质量不再变化,停止加热,继续通入O2至硬质玻璃管冷却。
步骤二:向装置D所得溶液中加入足量双氧水,再加入过量BaCl2溶液;将生成的沉淀过滤、洗涤、干燥、称量得沉淀质量为23.3 g。
(1)装置C中用于加热的仪器名称为___________________。
(2)步骤一中,停止加热后,继续通入O2的主要作用为___________________。
(3)由实验数据推断得CuxSy的化学式为___________________。
(4)若无装置E,则所测x∶y的值 ________(填“偏大”“ 偏小”或“无影响”)。.
Ⅱ.该小组选用实验I中的装置A、B、C和下图所示装置,依次验证SO2的漂白性,氧化性和还原性。

(5)按气流方向,装置的合理连接顺序为A→B→C→______________(填装置字母)。
(6)试剂X的名称为_____________。能证明SO2有还原性的实验现象为______________。
(7)装置G中发生反应的离子方程式为________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com