
【题目】下列叙述正确的是( )
A.硫离子的结构示意图为 
B.核外电子排布相同的微粒化学性质也相同
C.氢弹中用到的2H,3H互为同位素
D.同种元素的原子均有相同的质子数和中子数
科目:高中化学 来源: 题型:
【题目】近年来对CO2的有效控制及其高效利用的研究正引起全球广泛关注.由CO2制备甲醇过程可能涉及反应如下:
反应Ⅰ:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H1=﹣49.58kJmol﹣1
反应Ⅱ:CO2(g)+H2(g)CO (g)+H2O(g)△H2
反应Ⅲ:CO(g)+2H2(g)CH3OH(g)△H3=﹣90.77kJmol﹣1
回答下列问题:
(1)反应Ⅱ的△H2= , 反应Ⅲ自发进行条件是(填“较低温”、“较高温”或“任何温度”).
(2)在一定条件下2L恒容密闭容器中充入一定量的H2和CO2仅发生反应Ⅰ,实验测得在不同反应物起始投入量下,反应体系中CO2的平衡转化率与温度的关系曲线,如图1所示.
①据图可知,若要使CO2的平衡转化率大于40%,以下条件中最合适的是
A.n(H2)=3mol,n(CO2)=1.5mol; 650KB.n(H2)=3mol,n(CO2)=1.7mol;550K
C.n(H2)=3mol,n(CO2)=1.9mol; 650KD.n(H2)=3mol,n(CO2)=2.5mol;550K
②在温度为500K的条件下,充入3mol H2和1.5mol CO2 , 该反应10min时达到平衡:
a.用H2表示该反应的速率为;
b.该温度下,反应I的平衡常数K=;
c.在此条件下,系统中CH3OH的浓度随反应时间的变化趋势如图所示,当反应时间达到3min时,迅速将体系温度升至600K,请在图2中画出3~10min内容器中CH3OH浓度的变化趋势曲线:
(3)某研究小组将一定量的H2和CO2充入恒容密闭容器中并加入合适的催化剂(发生反应I、Ⅱ、Ⅲ),测得在不同温度下体系达到平衡时CO2的转化率(a)及CH3OH的产率(b),如图3所示,请回答问题:
①该反应达到平衡后,为同时提高反应速率和甲醇的生成量,以下措施一定可行的是(选填编号).
A.改用高效催化剂 B.升高温度C.缩小容器体积 D.分离出甲醇 E.增加CO2的浓度
②据图可知当温度高于260℃后,CO的浓度随着温度的升高而(填“增大”、“减小”、“不变”或“无法判断”),其原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用锌片与1 mol·L-1稀盐酸反应制取氢气时,下列措施不能使氢气生成速率增大的是
A. 对该反应体系加热
B. 用浓硫酸代替稀盐酸
C. 不用锌片,改用锌粉
D. 加入少量1 mol·L-1硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在苯的同系物中加入少量KMnO4酸性溶液,振荡后褪色,正确的解释为 ( )
A.苯的同系物分子中的碳原子数比苯分子中的碳原子数多
B.苯环受侧链影响易被氧化
C.侧链受苯环影响易被氧化
D.由于苯环和侧链的相互影响均易被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究大气中含硫化合物(主要是SO2和H2S)的转化对环境保护具有重要意义.
(1)SO2的大量排放会引起严重的环境问题是 , 潮湿条件下,写出大气中SO2转化为HSO3﹣的方程式 .
(2)土壤中的微生物可将大气中H2S经两步反应氧化成SO42﹣ , 两步反应的能量变化示意图1如下:
1mol H2S(g)全部氧化成SO42﹣(aq)的热化学方程式为
(3)SO2是工业制硫酸的原料气体之一,一定温度下,向容积为2L的密闭容器中充入一定量的SO2和O2 , 发生反应:2SO2(g)+O2(g)2SO3(g),过程中测定的部分数据见表:
时间/min | n(SO2)/mol | n(O2)/mol |
0 | 0.10 | 0.050 |
4 | 0.050 | 0.025 |
5 | 0.040 | |
8 | 0.020 |
①反应在0~4min内的平均速率为v(SO2)=;
②此温度下该反应的化学平衡常数K= ,
③8min时,维持温度不变,往反应容器中再通入0.020mol SO2(g),0.010mol O2(g),重新达到平衡时混合气体中SO2的百分含量将(填“减小”,“增大”或“不变”).(4)将H2S 和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图2所示:
①在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌.欲使生成的硫单质中不含CuS,可采取的措施有 .
②一般来说,如果一个反应的平衡常数大于105 , 通常认为反应进行得较完全;相反,如果一个反应的平衡常数小于10﹣5 , 则认为这个反应很难进行.已知常温下各物质的溶度积及电离平衡常数:
CuS:Ksp=6.3×10﹣36;H2S:K a1=1.3×10﹣7 , K a2=7.1×10﹣15 ,
通过计算说明反应CuS(s)+2H+ (aq)=Cu2+(aq)+H2S(aq)进行的程度 . 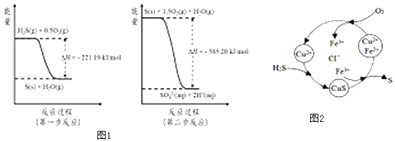
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,海水的综合利用具有重要意义(如下图)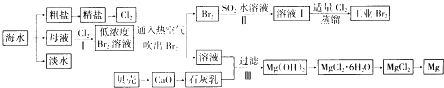
(1)氯碱工业主要以食盐为原料,为了除去粗盐中的Ca2+、Mg2+、SO42﹣及泥沙,可将粗盐溶于水,然后进行下列操作:①加过量的NaOH溶液;②加过量的BaCl2溶液③加过量的Na2CO3溶液;④过滤;⑤加适量的盐酸,第③步操作的目的是
(2)在实验室可以用萃取的方法提取溴,在萃取操作过程中,下列说法不正确的是 .
A.萃取剂可选用苯、CCl4、裂化汽油等有机溶剂.
B.萃取分液时下层液体从下口放出,上层液体从上口倒出
C.在萃取过程中,需要振荡分液漏斗,并打开分液漏斗上口的玻璃塞放气.
(3)通入热空气吹出溴,并用SO2的水溶液吸收的目的是 .
(4)步骤Ⅰ中用硫酸酸化可提高Cl2利用率的原因是 .
(5)步骤Ⅲ中有关反应的离子方程式 , 解释该反应能够发生的原因 .
(6)海水提溴蒸馏过程中,温度应控制在80﹣90℃,温度过高或过低都不利于生产,请解释原因 .
(7)工业上不用电解熔融MgO制金属镁,理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于强、弱电解质的叙述不正确的是
A.强电解质在溶液中完全电离成阴、阳离子
B.强电解质溶液导电能力不一定比弱电解质溶液导电能力强
C.同一弱电解质同浓度的溶液,温度不同时,导电能力不同
D.强电解质易溶于水,弱电解质一定难溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列检验方法与结论相符的一组是( )
序号 | 检 验 方 法 | 结 论 |
A | 向一种未知溶液中滴加AgNO3溶液,有白色沉淀 | 未知溶液中一定含有Cl﹣ |
B | 向一种未知溶液中滴加盐酸,有气泡产生 | 未知溶液中一定含有CO |
C | 将一种未知气体通入品红溶液,溶液褪色,加热后又恢复红色 | 未知气体是SO2 |
D | 向一种未知溶液中滴加BaCl2溶液,有白色沉淀 | 未知溶液中一定含有SO |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32﹣、SO42﹣、NO3﹣中的几种.①若加入锌粒,产生无色无味无毒的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀的物质的量与加入NaOH的物质的量之间的关系如右图所示.则下列说法正确的是( ) 
A.溶液中的阳离子只有H+、Mg2+、Al3+
B.溶液中一定不含CO32﹣ , 一定含有SO42﹣和NO3﹣
C.溶液中n(NH4+)=0.2 mol
D.三种离子的物质的量之比n(H+):n(Al3+):n(Mg2+)=1:1:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com