
| A、实验中可观察到有气体生成 |
| B、往反应后的溶液中直接加入AgNO3溶液可检验是否有Br-生成 |
| C、逸出的气体可直接通入到酸性高锰酸钾溶液中检验是否有乙烯生成 |
| D、生成的产物只有一种 |
| 乙醇 |
| △ |
| 乙醇 |
| △ |


科目:高中化学 来源: 题型:
| A、5.6L |
| B、6.72L |
| C、1.344L |
| D、11.2L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分别滴加0.1 mol?L-1的盐酸,看气泡产生的快慢 |
| B、分别取样在试管中加热,将可能产生的气体通入澄清石灰水,观察有无白色沉淀生成 |
| C、分别取样配成溶液,滴加Ba(OH)2溶液,观察有无白色沉淀 |
| D、分别配成溶液,做焰色反应实验,观察火焰的颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④ | B、①③ |
| C、②④ | D、②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
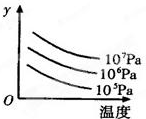 有某可逆反应aA(g)+bB(g)cC(g);△H=Q kJ/mol如图表示外界条件(温度、压强)的变化对上述反应的影响.下列判断正确的是( )
有某可逆反应aA(g)+bB(g)cC(g);△H=Q kJ/mol如图表示外界条件(温度、压强)的变化对上述反应的影响.下列判断正确的是( )| A、a+b<c时,y轴表示平衡混合气中C的质量分数 |
| B、a+b>c时,y轴表示平衡混合气的平均摩尔质量 |
| C、Q>0时,y轴表示达到平衡时B的转化率 |
| D、Q<0时,y轴表示达到平衡时A的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (一)电解饱和食盐水的阳极产物是
(一)电解饱和食盐水的阳极产物是查看答案和解析>>
科目:高中化学 来源: 题型:
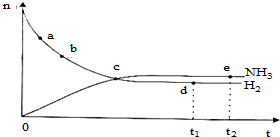 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)═2NH3(g)△H<0,673K,30M Pa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)═2NH3(g)△H<0,673K,30M Pa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A、点a的正反应速率比点b的大 |
| B、点c处反应达到平衡 |
| C、点d(t1时刻)和点e(t2时刻)处n(N2)不一样 |
| D、点c处用氨气的浓度表示的速率等于用氢气的浓度表示的速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com