
 (g)+Cl2(g)?
(g)+Cl2(g)? (g)+HCl(g)△H
(g)+HCl(g)△H| t/min | 0 | 1 | 2 | 5 | 10 |
| n(HCl)/mol | 0 | 0.12 | 0.20 | 0.32 | 0.32 |
| A. | 反应在0~2 min内的平均速率v(α-氯乙基苯)=0.10mol•L-1•min-1 | |
| B. | 10 min后,若保持其他条件不变,升高温度,达到新平衡时测得c(α-氯乙基苯)=0.18mol•L-1,则反应的△H>0 | |
| C. | 在T℃时,起始时若向容器中充入1.0 mol乙苯(g)、0.50 mol Cl2(g)和0.50 molα-氯乙基苯(g)、0.50 mol HCl(g),则反应将向正反应方向进行 | |
| D. | 在T℃时,起始时若向容器中充入2.0molα-氯乙基苯(g)和2.2mol HCl(g),达到平衡时,α-氯乙基苯(g)的转化率小于20% |
分析 A.根据数据图表,反应在0~2min内,HCl的物质的量增加了0.20mol,根据反应原理方程式,α-氯乙基苯应生成了0.20mol,根据化学反应平均速率为$v(α-氯乙基苯)=\frac{△n}{V△t}$计算即可;
B.平衡时,HCl的物质的量为0.32mol,根据反应方程式,平衡时,α-氯乙基苯的浓度应为$c=\frac{0.32mol}{2L}=0.16mol/L$,10min后升高温度,新平衡时α-氯乙基苯的浓度为c′=0.18mol/L,可见化学平衡向右移动,据此分析焓变;
C.T℃时,根据表中数据可计算此温度下的化学反应平衡常数,温度不变,则化学平衡常数不发生改变,起始时冲入另一种情况下的各反应物的量,根据浓度商与平衡常数的关系判断化学反应的方向;
D.T℃时,原先向容器中冲入0.2mol/L的乙苯和0.2mol/L的Cl2,反应为气体分子数守恒的反应,反应可等效平衡为起始时冲入0.2mol/Lα-氯乙基苯和0.2mol/L的HCl,若向容器中冲入2molα-氯乙基苯和2.2molHCl,即1mol/Lα-氯乙基苯和1.1mol/LHCl,根据等效平衡分析转化率.
解答 解:A.由数据图表可知,反应在0~2min内,HCl的物质的量增加了0.20mol,根据反应原理方程式,α-氯乙基苯作为生成物,在反应中生成了0.20mol,即△n=0.2mol,容器体积为V=2L,反应所经历的时间为△t=2min,则反应在0~2 min内的平均速率v(α-氯乙基苯)=$\frac{△n}{V△t}$=$\frac{0.2mol}{2L×2min}=0.05mol/(L•min)$.故A错误;
B.平衡时,HCl的物质的量为0.32mol,根据反应方程式,平衡时,α-氯乙基苯的浓度应为$c=\frac{0.32mol}{2L}=0.16mol/L$,10min后升高温度,反应达到新平衡时α-氯乙基苯的浓度为c′=0.18mol/L,因此升高温度,化学平衡右移,表明正反应是吸热反应,吸热反应的焓变△H>0,故B正确;
C..T℃时,根据表中数据和反应的方程式,平衡时,$c(乙苯)=\frac{0.4-0.32}{2}=0.04mol/L$,$c(C{l}_{2})=\frac{0.4-0.32}{2}=0.04mol/L$,$c(α-氯乙基苯)=\frac{0.32}{2}=0.16mol/L$,$c(HCl)=\frac{0.32}{2}=0.16mol/L$,可计算此温度下的化学反应平衡常数$K=\frac{c(HCl)c(α-氯乙基苯)}{c(C{l}_{2})c(乙苯)}$=$\frac{0.16mol/L×0.16mol/L}{0.04mol/L×0.04mol/L}$=16,若起始时,向容器中充入1.0 mol乙苯(g)、0.50 mol Cl2(g)和0.50 molα-氯乙基苯(g)、0.50 mol HCl(g),反应的浓度商为$J=\frac{\frac{0.5}{2}mol/L×\frac{0.5}{2}mol/L}{\frac{0.5}{2}mol/L×\frac{1}{2}mol/L}=0.5$<K,因此反应向正反应方向进行.故C正确;
D..T℃时,原先向容器中冲入0.2mol/L的乙苯和0.2mol/L的Cl2,反应为气体分子数守恒的反应,反应可等效平衡为起始时冲入0.2mol/Lα-氯乙基苯和0.2mol/L的HCl,若向容器中冲入2molα-氯乙基苯和2.2molHCl,即1mol/Lα-氯乙基苯和1.1mol/LHCl,则1mol/Lα-氯乙基苯和1.1mol/LHCl可看成是在1mol/Lα-氯乙基苯和1mol/LHCl的基础上增加了0.1mol/L的HCl,而对于反应为气体数守恒的反应来讲,1mol/Lα-氯乙基苯和1mol/LHCl相对于0.2mol/Lα-氯乙基苯和0.2mol/L的HCl,等效平衡为加压,加压并不改变该反应的平衡,平衡时,α-氯乙基苯的转化率就是20%,现在在1mol/Lα-氯乙基苯和1mol/LHCl的基础上又加入了0.1mol/L的HCl,可使平衡向佐移动,那么α-氯乙基苯(g)的转化率>20%.故D错误.
故选BC.
点评 本题考查化学平衡的移动,化学反应速率的计算,化学平衡常数的计算和简单应用,等效平衡的知识.题目难度中等,是中档题.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 由于Al的活泼性强,故工业上采用电解熔融AlCl3的方法生产Al | |
| B. | 可以用钠加入氯化镁饱和溶液中制取镁 | |
| C. | 炼铁高炉中所发生的反应都是放热的,故无需加热 | |
| D. | 金属冶炼的本质是将化合态金属还原为游离态,冶炼方法由金属的活泼性决定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
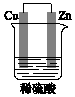 某原电池装置如图所示.
某原电池装置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 25℃时,用0.01mol•L-1的氢氧化钠溶液滴定20mL同浓度的HA溶液,滴定曲线如图所示[AG=1g$\frac{c({H}^{+})}{c(O{H}^{-})}$].下列有关叙述正确的是( )
25℃时,用0.01mol•L-1的氢氧化钠溶液滴定20mL同浓度的HA溶液,滴定曲线如图所示[AG=1g$\frac{c({H}^{+})}{c(O{H}^{-})}$].下列有关叙述正确的是( )| A. | 由图可知HA为强酸 | |
| B. | 滴定终点应为于OA段之间 | |
| C. | A点对应溶液中:c(A-)=c(Na+) | |
| D. | 当滴入NaOH溶液10mL时,所得溶液中:c(Na+)>c(A-)>c(HA)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2溶于水得到NaOH,所以Na2O2为碱性氧化物 | |
| B. | NaHSO4溶液、Na2CO3溶液分别呈酸性、碱性,则NaHSO4属于酸,Na2CO3属于碱 | |
| C. | HCl、NH3的水溶液都能导电,则HCl、NH3均属于电解质 | |
| D. | 用一束光照射稀豆浆时产生丁达尔效应,则稀豆浆属于胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 甲,乙两同学用图所示装置进行实验探究硝酸与铁反应的产物.
甲,乙两同学用图所示装置进行实验探究硝酸与铁反应的产物.| 实验操作 | 实验现象 |
| 打开弹簧夹,通入一段时间CO2,关闭弹簧夹. | |
| 打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞. | 无明显现象. |
| 加热烧瓶,反应开始后停止加热. | ①A中有红棕色气体产生,一段时间后,气体颜色逐渐变浅; B中溶液变棕色; C中溶液紫色变浅. ②反应停止后,A中无固体剩余,得100mL的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某温度时,在2L密闭容器中,三种气态物质X、Y、Z的物质的量(n)随时间(t)变化的曲线如图所示,可得:
某温度时,在2L密闭容器中,三种气态物质X、Y、Z的物质的量(n)随时间(t)变化的曲线如图所示,可得:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com