
| A. | Na2O2溶于水得到NaOH,所以Na2O2为碱性氧化物 | |
| B. | NaHSO4溶液、Na2CO3溶液分别呈酸性、碱性,则NaHSO4属于酸,Na2CO3属于碱 | |
| C. | HCl、NH3的水溶液都能导电,则HCl、NH3均属于电解质 | |
| D. | 用一束光照射稀豆浆时产生丁达尔效应,则稀豆浆属于胶体 |
分析 A、能和酸反应生成盐和水的氧化物为碱性氧化物;
B、电离出的阳离子全部是氢离子的化合物为酸,电离出的阴离子全部是氢氧根的化合物为碱;
C、氨气溶于水后是生成的一水合氨电离出自由移动离子而导电;
D、丁达尔效应是胶体所特有的性质.
解答 解:A、能和酸反应生成盐和水的氧化物为碱性氧化物,而过氧化钠和酸反应后除了生成盐和水,还生成氧气,故不是碱性氧化物,故A错误;
B、电离出的阳离子全部是氢离子的化合物为酸,而NaHSO4电离出的阳离子除了氢离子外,还有钠离子,故不是酸;电离出的阴离子全部是氢氧根的化合物为碱,而Na2CO3的阳离子是金属离子、阴离子是酸根离子,故是盐而不是碱,故B错误;
C、氨气在熔融状态下不带电,而溶于水后是生成的一水合氨电离出自由移动离子而导电,和氨气本身无关,故氨气是非电解质,故C错误;
D、丁达尔效应是胶体所特有的性质,稀豆浆有丁达尔效应,故是胶体,故D正确.
故选D.
点评 本题考查了碱性氧化物、酸、碱和电解质、非电解质的判断以及胶体的性质,难度不大,注意基础的掌握.


科目:高中化学 来源: 题型:选择题
| 选项 | 物质(杂质) | 除杂质所用试剂及方法 |
| A | 乙醇(水) | 加入生石灰蒸馏 |
| B | 苯(苯酚) | 加入浓溴水振荡后过滤 |
| C | 溴乙烷(溴单质) | 加入NaHSO3溶液振荡、静置、分液 |
| D | 甲烷(乙烯) | 依次通过KMnO4酸性溶液、NaOH溶液洗气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
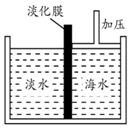 海水中含有丰富的Na+、Mg2+、Cl-、Br-等化学资源.将海水淡化与浓缩海水结合是综合利用海水资源的途径之一.以浓缩海水为原料,通过一系列工艺流程可以提取Mg、Br2等产品.
海水中含有丰富的Na+、Mg2+、Cl-、Br-等化学资源.将海水淡化与浓缩海水结合是综合利用海水资源的途径之一.以浓缩海水为原料,通过一系列工艺流程可以提取Mg、Br2等产品.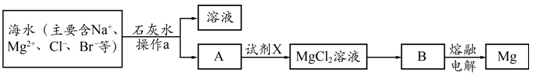
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在t℃时,Ag2CrO4(橘红色) 在水溶液中沉淀溶解平衡曲线如图所示.又知AgCl的Ksp=1.8×10-10.下列说法正确的是( )
在t℃时,Ag2CrO4(橘红色) 在水溶液中沉淀溶解平衡曲线如图所示.又知AgCl的Ksp=1.8×10-10.下列说法正确的是( )| A. | 将AgNO3溶液滴加到KCl溶液中,反应的活化能几乎为零 | |
| B. | t℃时,Ag2CrO4的Ksp=1×10-8 | |
| C. | 饱和Ag2CrO4溶液中,加入水能使溶液由X点变为Y点 | |
| D. | t℃时,AgCl比Ag2CrO4的溶解度大 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 (g)+Cl2(g)?
(g)+Cl2(g)? (g)+HCl(g)△H
(g)+HCl(g)△H| t/min | 0 | 1 | 2 | 5 | 10 |
| n(HCl)/mol | 0 | 0.12 | 0.20 | 0.32 | 0.32 |
| A. | 反应在0~2 min内的平均速率v(α-氯乙基苯)=0.10mol•L-1•min-1 | |
| B. | 10 min后,若保持其他条件不变,升高温度,达到新平衡时测得c(α-氯乙基苯)=0.18mol•L-1,则反应的△H>0 | |
| C. | 在T℃时,起始时若向容器中充入1.0 mol乙苯(g)、0.50 mol Cl2(g)和0.50 molα-氯乙基苯(g)、0.50 mol HCl(g),则反应将向正反应方向进行 | |
| D. | 在T℃时,起始时若向容器中充入2.0molα-氯乙基苯(g)和2.2mol HCl(g),达到平衡时,α-氯乙基苯(g)的转化率小于20% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达到反应限度时SO2的消耗速率必定等于O2的生成速率 | |
| B. | 达到反应限度时,反应放出197kJ 的热量 | |
| C. | 达到反应限度时SO2、O2、SO3的分子数之比一定为2:1:2 | |
| D. | SO2和SO3物质的量之和一定为2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲、乙、丙、丁 | B. | 乙、甲、丁、丙 | C. | 甲、乙、丁、丙 | D. | 乙、甲、丙、丁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,用浓度为0.1000mol•L-1的NaOH溶液分别逐滴加入到20.00mL 0.1000mol•L-1的HX、HY溶液中,pH随NaOH溶液体积的变化如图.下列说法正确的是( )
常温下,用浓度为0.1000mol•L-1的NaOH溶液分别逐滴加入到20.00mL 0.1000mol•L-1的HX、HY溶液中,pH随NaOH溶液体积的变化如图.下列说法正确的是( )| A. | V(NaOH)=0 mL时,两份溶液中,c(X-)>c(Y-) | |
| B. | V(NaOH)=10.00 mL时,c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-) | |
| C. | V(NaOH)=20.00 mL时,c(OH-)>c(H+)>c(Na+)>c(X-) | |
| D. | pH=7时,两份溶液中,c(X-)=c(Na+)=c(Y-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com