
【题目】14C的放射性可用于考古断代。下列关于14C的说法中正确的是
A. 质量数为6 B. 质子数为6 C. 电子数为14 D. 中子数为14
科目:高中化学 来源: 题型:
【题目】以苯为主要原料,制取高分子材料N和R的流程如下:

已知: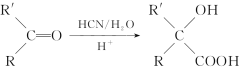
(1)B中含氧官能团的名称是________。
(2)由![]() 生成
生成![]() 的反应类型是________。
的反应类型是________。
(3)反应Ⅰ的反应条件是________。
(4)化合物C的结构简式是________。
(5)反应Ⅱ的化学反应方程式是________。
(6)下列说法正确的是________(填字母)。
a.A可与NaOH溶液反应
b.常温下,A能和水以任意比混溶
c.化合物C可使酸性高锰酸钾溶液褪色
d.E存在顺反异构体
(7)反应Ⅲ的化学反应方程式是________。
(8)符合下列条件的B的同分异构体有________种。
a.能与饱和溴水反应生成白色沉淀
b.属于酯类
c.苯环上只有两个对位取代基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于胶体和溶液的说法中正确的是( )
A.胶体不均一、不稳定,静置后易产生沉淀;溶液均一、稳定,静置后不产生沉淀
B.布朗运动是胶体粒子特有的运动方式,可以据此将胶体与溶液、悬浊液区分开来
C.光线通过时,胶体发生丁达尔效应,溶液则不能发生丁达尔效应
D.只有胶状物如胶水、果冻类的物质才能称为胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X(s)+3Y(g)![]() Z(g) ΔH=-a kJ·molˉ1 ,一定条件下,将2mol X和2 mol Y通入2L的恒容密闭容器中,反应10s,测得生成0.5molZ。下列说法正确的是
Z(g) ΔH=-a kJ·molˉ1 ,一定条件下,将2mol X和2 mol Y通入2L的恒容密闭容器中,反应10s,测得生成0.5molZ。下列说法正确的是
A.10s内,X的平均反应速率为0.025 mol·Lˉ1·sˉ1
B.第10s时,Y的反应速率为0.075 mol·Lˉ1·sˉ1
C.第10s时,X为 1.5 mol,Y的浓度为0.25 mol·Lˉ1
D.10s内,X和Y反应放出的热量为a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“盐水动力”玩具车的电池以镁片、活性炭为电极,向极板上滴加食盐水后电池便可工作,电池反应为2Mg+O2+2H2O = 2Mg (OH)2 下列关于该电池的说法错误的是

A.Mg电极的电极反应式:Mg-2e-=Mg2+
B.这种电池的工作原理可以认为是镁的吸氧腐蚀
C.活性炭电极上发生氧化反应
D.电池工作时实现了化学能向电能的转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在298K、1.01×10 5Pa下,将22gCO2通入750mLl mol./LNaOH溶液中充分反应,测得反应放出xkJ的热量。己知在该条件下,1molCO2通入lL2mol ·L-1NaOH溶液中充分反应放出y kJ的热量,则CO2与NaOH溶液反应生成NaHCO3的热化学方程式正确的是
A. CO2(g)+NaOH(aq)=NaHCO3(aq) △H=-(2y-x)kJ·mol-l
B. CO2(g)+NaOH(aq)=NaHCO3(aq) △H =-(2x-y) kJ·mol-l
C. CO2(g)+NaOH(aq)=NaHCO3(aq) △H =-(4x-y) kJ·mol-l
D. CO2(g)+NaOH(l)=NaHCO3(l) △H =-(4x-y) kJ·mol-l
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝基苯是重要的精细化工原料,是医药和染料的中间体,还可作有机溶剂。制备硝基苯的过程如下:
①组装如下图反应装置。配制混酸,取100 mL烧杯,用20 mL 浓硫酸与18 mL浓硝酸配制混酸,加入漏斗中,把18 mL 苯加入三颈烧瓶中。
②向室温下的苯中逐滴加入混酸,边滴边搅拌,混合均匀。
③在50~60 ℃下发生反应,直至反应结束。
④除去混酸后,粗产品依次用蒸馏水和10% Na2CO3溶液洗涤,最后再用蒸馏水洗涤得到粗产品。
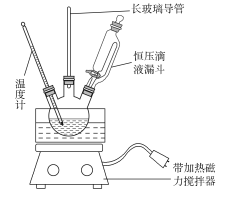
(2)可能用到的有关数据列表如下:
物 质 | 熔点/℃ | 沸点/℃ | 密度(20 ℃) /(g·cm-3) | 溶解性 |
苯 | 5.5 | 80 | 0.88 | 微溶于水 |
硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
1,3-二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
浓硝酸 | — | 83 | 1.4 | 易溶于水 |
浓硫酸 | — | 338 | 1.84 | 易溶于水 |
请回答下列问题:
(1)配制混酸应在烧杯中先加入________。
(2)恒压滴液漏斗的优点是__________________________________。
(3)实验装置中长玻璃导管可用________代替(填仪器名称)。
(4)反应结束后产品在液体的________层(填“上”或“下”),分离混酸和产品的操作方法为________________________________。
(5)用10%Na2CO3溶液洗涤之后再用蒸馏水洗涤时,怎样验证液体已洗净? __________________________。
(6)为了得到更纯净的硝基苯,还需先向液体中加入____________除去水,然后蒸馏。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质
B. HClO是弱酸,所以NaClO是弱电解质
C. HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物
D. 杂多酸盐Na2HPW12O40与Na3PW12O40都是强电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,l0mL 0.40mol/LH2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平衡反应速率:v(H2O2) ≈3.3×10-2mol/(L·min)
B. 6~10min的平衡反应速率:v(H2O2) <3.3×10-2mol/(L·min)
C. 反应到6min时, c (H2O2)=0.30mol/L
D.反应到6min时,H2O2分解了50%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com