
【题目】草酸钴是一种重要的化工材料,广泛应用于有机合成。一种以铜钴矿(主要成分为Co2CuS4,一定量CuFeS2)为原料,生产草酸钴晶体(CoC2O4·2H2O)的工艺流程:
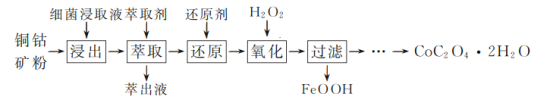
已知:①“浸出”液含有的离子主要有H+、Fe3+、Cu2+、Co3+、![]() ;
;
②pH增大,Fe2+被氧化的速率加快,同时生成的Fe3+水解形成更多的胶体;
③草酸钴晶体难溶于水;25℃时,Ksp[Co(OH)2]=1.6×10-15。
回答下列问题:
(1)生产时为提高铜钴矿粉浸出率,常采取的措施有________(填字母)。
a.适当延长浸出时间b.高温浸出c.分批加入细菌浸取液并搅拌
(2)“萃取”步骤中萃取除去的主要金属阳离子是________。
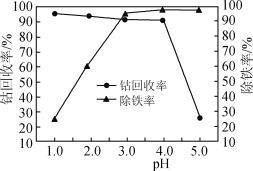
(3)“氧化”过程中,控制70℃、pH=4条件下进行,pH对除铁率和钴回收率的影响如图所示。
①用电子式表示H2O2的形成过程________。
②“氧化”过程的离子方程式为________。
③pH为4~5时,钴的回收率降低的原因是________。
(4)“过滤”后的滤液中加入(NH4)2C2O4溶液反应得到草酸钴晶体,过滤得到的草酸钴晶体需要用蒸馏水洗涤,检验晶体是否洗涤干净的方法是_______________。
(5)300℃时,在空气中煅烧CoC2O4·2H2O可制得Co3O4,该反应的化学方程式为________。
【答案】ac Cu2+ ![]() 2Fe2++H2O2+2H2O
2Fe2++H2O2+2H2O![]() 2FeOOH+4H+ pH过高,Fe3+生成氢氧化铁胶体吸附大量Co2+,导致钴回收率降低 取最后一次的洗涤液少许于试管中,先加盐酸酸化,再加氯化钡溶液,若无沉淀生成,则证明洗涤干净 3CoC2O4·2H2O+2O2
2FeOOH+4H+ pH过高,Fe3+生成氢氧化铁胶体吸附大量Co2+,导致钴回收率降低 取最后一次的洗涤液少许于试管中,先加盐酸酸化,再加氯化钡溶液,若无沉淀生成,则证明洗涤干净 3CoC2O4·2H2O+2O2![]() Co3O4+6CO2+6H2O
Co3O4+6CO2+6H2O
【解析】
由题给流程可知,铜钴矿粉加入细菌浸取液浸取后,得到的溶液中含有的离子有H+、Fe3+、Cu2+、Co2+、SO42-;向溶液中加入萃取剂,用萃取剂除去溶液中的Cu2+;向萃取后的溶液中加入还原剂,将Fe3+还原为Fe2+,然后加入H2O2,将Fe2+氧化为FeOOH沉淀,除去溶液中的铁元素;过滤后,向滤液中加入(NH4)2C2O4溶液反应得到草酸钴晶体。
(1)a.适当延长浸出时间可以使反应更充分,提高浸出率,故正确;
b. 高温条件下可以加快反应速率,但是细菌在高温条件下会死亡,故不能用高温,故错误;
c. 分批加入细菌浸取液并搅拌能使反应物混合更均匀,更充分,提高浸出率,故正确;
ac正确,故答案为:ac;
(2)由流程分析可知,后续的操作不能除去Cu2+,故只能在萃取步骤中除去Cu2+,故答案为:Cu2+;
(3)①H2O2为共价化合物,分子中含有极性共价键和非极性共价键,用电子式表示过氧化氢的形成过程为![]() ,故答案为:
,故答案为:![]() ;
;
②由题意可知,氧化过程为70℃、pH=4条件下,过氧化氢与亚铁离子发生氧化还原反应生成FeOOH,反应的离子方程式为2Fe2++H2O2+2H2O![]() 2FeOOH+4H+,故答案为:2Fe2++H2O2+2H2O
2FeOOH+4H+,故答案为:2Fe2++H2O2+2H2O![]() 2FeOOH+4H+;
2FeOOH+4H+;
③由题给信息可知,溶液pH增大,Fe2+被氧化的速率加快,同时生成的Fe3+水解形成较多的胶体,氢氧化铁胶体具有很大的吸附能力,吸附大量Co2+,导致钴回收率降低,故答案为:pH过高,Fe3+生成氢氧化铁胶体吸附大量Co2+,导致钴回收率降低;
(4)由流程可知,草酸钴晶体表面附有可溶的硫酸铵,检验晶体是否洗涤干净实际上就是检验洗涤液中是否存在硫酸根,则检验方法为取最后一次的洗涤液少许于试管中,先加盐酸酸化,再加氯化钡溶液,若无沉淀生成,则证明洗涤干净,故答案为:取最后一次的洗涤液少许于试管中,先加盐酸酸化,再加氯化钡溶液,若无沉淀生成,则证明洗涤干净;
(5)由题意可知,300℃时,在空气中煅烧CoC2O4·2H2O可制得Co3O4,反应中Co元素化合价升高,依据氧化还原反应规律,空气中的O2参与反应,做反应的氧化剂,Co元素和C元素被氧化,反应的化学方程式为3CoC2O4·2H2O+2O2![]() Co3O4+6CO2+6H2O,故答案为:3CoC2O4·2H2O+2O2
Co3O4+6CO2+6H2O,故答案为:3CoC2O4·2H2O+2O2![]() Co3O4+6CO2+6H2O。
Co3O4+6CO2+6H2O。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】根据如下能量关系示意图分析,下列说法正确的是

A. 1molC(g)与1molO2(g)的能量之和为393.5kJ
B. 反应2CO(g)+O2(g)=2CO2(g)中,反应物的总键能小于生成物的总键能
C. C→CO的热化学方程式为2C(s) +O2(g)=2CO(g) △H=-110.6kJ/mol
D. 热值是指一定条件下单位质量的物质完全燃烧所放出的热量,则CO的热值△H=10.1kJ/g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以白云石(主要成分为CaCO3和MgCO3)为原料制备氧化镁和轻质碳酸钙的一种工艺流程如下:
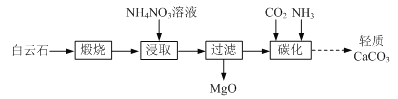
已知:Ksp[Mg(OH)2] = 5×1012
(1)白云石高温煅烧所得固体产物的主要成分为_______(填化学式)。
(2)NH4NO3溶液呈酸性的原因为_______(用离子方程式表示)。
(3)“浸取”后,c(Mg2+)应小于5×106 mol·L1,则需控制溶液pH ______。
(4)“碳化”反应的化学方程式为_______。
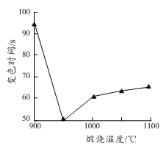
(5)煅烧所得固体的活性与其中CaO含量及固体疏松程度有关。其他条件相同时,将不同温度下的煅烧所得固体样品加入酸化的酚酞溶液中,引起溶液变色所需时间不同,由此可知煅烧所得固体的活性差异。溶液变色的时间与各样品煅烧温度的关系如图所示。当温度高于950 ℃时,煅烧所得固体易板结,活性降低;当温度低于950 ℃时,活性降低的原因为_______。将不同温度下的煅烧所得固体样品加入水中,也可测量其活性,则此时需测量的数据为相同时间后_______与样品煅烧温度之间的关系。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是合成降压药替米沙坦的重要中间体,其人工合成路线如下:
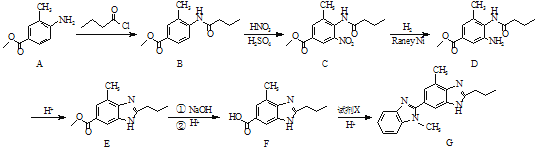
(1)C中含氧官能团的名称为酰胺键、_______和________。
(2)A→B的反应类型为______。
(3)试剂X的分子式为C7H10N2,写出X的结构简式:________。
(4)A的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:______。
①是α-氨基酸;
②苯环上有3种不同化学环境的氢原子。
(5)已知:①苯胺(![]() )有还原性,易被氧化;
)有还原性,易被氧化;
②硝基苯直接硝化产物为间二硝基苯
③![]()
![]() CH3COO-+CH3NH2
CH3COO-+CH3NH2
写出以![]() 和
和![]() 为原料制备
为原料制备![]() 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。______________________________
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】喷泉实验是一种常见的自然现象,其产生原因是存在压强差。试根据如图,回答下列问题:
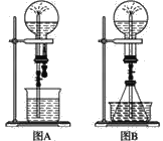
(1)在图A的烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体。下列组合中不可能形成喷泉的是(________)
A.氯化氢和水
B.氯气和氢氧化钠溶液
C.氯化氢和汽油
D.二氧化碳和氢氧化钠溶液
(2)在图B的锥形瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是(________)
A.铜与稀盐酸
B.碳酸氢钠与氢氧化钠溶液
C.碳酸钙与稀硫酸
D.碳酸氢铵与稀盐酸
(3)在图B的锥形瓶外放一水槽,锥形瓶中加入酒精,水槽中加入冷水后,再加入足量的下列物质,结果也产生了喷泉。水槽中加入的物质不可能是(________)。
A.浓硫酸 B.生石灰
C.硝酸铵 D.烧碱
(4)比较图A和图B两套装置,以产生喷泉的原理来分析,图A是__上部烧瓶内压强;城市中常见的人造喷泉及火山爆发的原理与上述__(填“图A”或“图B”)装置的原理相似。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标况下,一容积不变的密闭容器里充满硫化氢和氧气的混合气体,点燃恰好完全反应后,恢复至原状态,压强变为原来的![]() ,计算原混合气体的硫化氢和氧气的体积比________。
,计算原混合气体的硫化氢和氧气的体积比________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝和某些金属氧化物在高温下的置换反应称为“铝热反应”,比如:4Al+3MnO2![]() 2Al2O3+3Mn,下列有关说法错误的是
2Al2O3+3Mn,下列有关说法错误的是
A.该反应为置换反应
B.反应中氧化剂为MnO2,氧化产物为Mn
C.从反应可以比较还原性:Al强于Mn
D.反应中生成1mol Al2O3时,转移的电子数为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把2.0 mol·L-1 CuSO4和1.0 mol·L1 H2SO4溶液等体积混合(假设混合后的溶液的体积等于混合前两种溶液的体积之和)计算:
(1)混合溶液中CuSO4和H2SO4的物质的量浓度c(CuSO4)=________;c(H2SO4)=________。
(2)混合液中H+和SO42-的物质的量浓度c(H+)=________;c(SO42-)=________。
(3)向溶液中加入铁粉,经过足够长的时间,铁粉有剩余。此时溶液中的物质的量浓度c(Fe2+)=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把0.4molX气体和0.6molY气体混合于2L密闭容器中,使它们发生如下反应:4X(g)+5Y(g) ![]() nZ(g)+6W(g)。2min末已生成0.3molW,若测知以Z的浓度变化表示的反应速率为0.05mol/(L·min),试计算
nZ(g)+6W(g)。2min末已生成0.3molW,若测知以Z的浓度变化表示的反应速率为0.05mol/(L·min),试计算
(1)前2min内用W的浓度变化表示的平均反应速率为_______________。
(2)2min末时Y的浓度为_____________________________。
(3)化学反应方程式中n=_____________________________。
(4)2min末,恢复到反应前温度,体系内压强是反应前压强的__________倍。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com