
【题目】铝和某些金属氧化物在高温下的置换反应称为“铝热反应”,比如:4Al+3MnO2![]() 2Al2O3+3Mn,下列有关说法错误的是
2Al2O3+3Mn,下列有关说法错误的是
A.该反应为置换反应
B.反应中氧化剂为MnO2,氧化产物为Mn
C.从反应可以比较还原性:Al强于Mn
D.反应中生成1mol Al2O3时,转移的电子数为6NA
【答案】B
【解析】
4Al+3MnO2![]() 2Al2O3+3Mn中,Al的化合价升高,是还原剂,发生氧化反应,得到氧化产物Al2O3,MnO2中Mn的化合价降低,是氧化剂,发生还原反应,得到还原产物Mn。
2Al2O3+3Mn中,Al的化合价升高,是还原剂,发生氧化反应,得到氧化产物Al2O3,MnO2中Mn的化合价降低,是氧化剂,发生还原反应,得到还原产物Mn。
A、该反应为单质与化合物反应得到另一种单质和化合物的反应,属于置换反应,A正确,不符合题意;
B、MnO2中Mn的化合价降低,是氧化剂,发生还原反应,得到还原产物Mn,B错误,符合题意;
C、在氧化还原反应中,还原剂的还原性大于还原产物,Al为还原剂,Mn为还原产物,则还原性Al>Mn,C正确,不符合题意;
D、Al的化合价从0升高到+3,生成1molAl2O3,总转移2×3mol=6mol电子,则转移的电子数为6NA,D正确,不符合题意;
答案选B。


科目:高中化学 来源: 题型:
【题目】某铝合金(硬铝)中含有铝、镁、铜、硅,为了测定该合金中铝的含量,有人设计了如下实验:
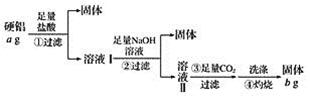
(1)溶液Ⅰ中的溶质为_________(填化学式,下同),溶液Ⅱ中的溶质为__________。
(2)上述第③步反应中,生成沉淀的离子方程式为____________。
(3)该合金中铝的含量为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中的一定量混合气体发生反应:![]() 平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.30mol/L。下列有关判断正确的是
平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.30mol/L。下列有关判断正确的是
A.x+y﹤zB.平衡向正反应方向移动
C.B的转化率降低D.C的体积分数升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸钴是一种重要的化工材料,广泛应用于有机合成。一种以铜钴矿(主要成分为Co2CuS4,一定量CuFeS2)为原料,生产草酸钴晶体(CoC2O4·2H2O)的工艺流程:
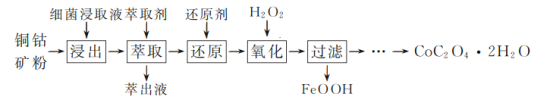
已知:①“浸出”液含有的离子主要有H+、Fe3+、Cu2+、Co3+、![]() ;
;
②pH增大,Fe2+被氧化的速率加快,同时生成的Fe3+水解形成更多的胶体;
③草酸钴晶体难溶于水;25℃时,Ksp[Co(OH)2]=1.6×10-15。
回答下列问题:
(1)生产时为提高铜钴矿粉浸出率,常采取的措施有________(填字母)。
a.适当延长浸出时间b.高温浸出c.分批加入细菌浸取液并搅拌
(2)“萃取”步骤中萃取除去的主要金属阳离子是________。
(3)“氧化”过程中,控制70℃、pH=4条件下进行,pH对除铁率和钴回收率的影响如图所示。
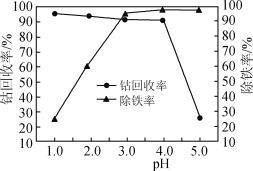
①用电子式表示H2O2的形成过程________。
②“氧化”过程的离子方程式为________。
③pH为4~5时,钴的回收率降低的原因是________。
(4)“过滤”后的滤液中加入(NH4)2C2O4溶液反应得到草酸钴晶体,过滤得到的草酸钴晶体需要用蒸馏水洗涤,检验晶体是否洗涤干净的方法是_______________。
(5)300℃时,在空气中煅烧CoC2O4·2H2O可制得Co3O4,该反应的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳樟醇(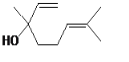 )是常用的香料,下列有关芳樟醇说法正确的是
)是常用的香料,下列有关芳樟醇说法正确的是
A.能使酸性高锰酸钾溶液和溴水均褪色的原理不同
B.分子中所有碳原子共平面
C.与溴的CCl4溶液反应,产物仅有两种
D.与有机物![]() 互为同系物
互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H 1=-90.7 kJ·mol-1 K1
CH3OH(g) △H 1=-90.7 kJ·mol-1 K1
②2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1 K2
CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1 K2
③CO(g)+H2O(g)![]() CO2(g)+H2(g) △H 3=-41.2kJ·mol-1 K3
CO2(g)+H2(g) △H 3=-41.2kJ·mol-1 K3
回答下列问题:
(1)则反应3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)的△H=____kJ·mol-1;该反应的平衡常数K=____(用K1、K2、K3表示)
CH3OCH3(g)+CO2(g)的△H=____kJ·mol-1;该反应的平衡常数K=____(用K1、K2、K3表示)
(2)下列措施中,能提高CH3OCH3产率的有____。
A.使用过量的CO B.升高温度 C.增大压强
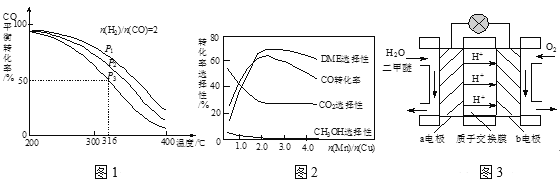
(3)将合成气以n(H2)/n(CO)=2通入1 L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是____。
CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是____。
A.△H <0
B.P1>P2>P3:
C.若在P3和316℃时,起始时n(H2)/n(CO)=3,则达到平衡时,CO转化率小于50%
(4)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚。观察图2回答问题。催化剂中n(Mn)/n(Cu)约为____时最有利于二甲醚的合成。
(5)图3为绿色电源“二甲醚燃料电池”的工作原理示意图,a电极的电极反应式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子液体由于其具有良好的化学稳定性,较低的熔点和良好的溶解性,应用越来越广泛。如图为某离子液体的结构,回答下列问题:
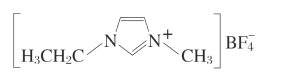
(1)基态N原子的价电子排布图为______。![]() 中,B原子杂化方式为______,与
中,B原子杂化方式为______,与![]() 互为等电子体的含氧酸根离子是______(写出一种即可);在周期表中,与B的化学性质最相似的邻族元素是_____,它们性质相似的原因是_____。
互为等电子体的含氧酸根离子是______(写出一种即可);在周期表中,与B的化学性质最相似的邻族元素是_____,它们性质相似的原因是_____。
(2)NH3极易溶于水的原因与氢键有关,用“…”表示氢键,结合NH3·H2O的电离推测NH3·H2O可能结构式为_____。
(3)离子液体是在室温和室温附近温度下呈液态的盐类物质。该离子液体常温下为液体,而NaBF4常温下为固体,其原因是_____。
(4)分子中的大![]() 键可用符号
键可用符号![]() 表示,其中m代表参与形成大
表示,其中m代表参与形成大![]() 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大![]() 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大![]() 键可表示为
键可表示为![]() ),则该离子液体的阳离子中存在的一个大
),则该离子液体的阳离子中存在的一个大![]() 键可表示为_____。
键可表示为_____。
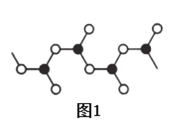
(5)某硼的含氧酸根离子为无限链状结构,节选部分结构如图1所示,其离子的化学式可用通式表示为_____(用n代表B原子数)。
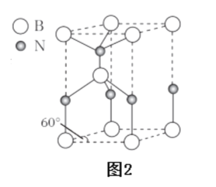
(6)某种含B和N两种元素的功能陶瓷,其晶胞结构如图2所示。已知该晶胞底面为菱形,其底边长为acm,高为bcm,晶体密度为_____g·cm-3(列出含有a,b,NA的计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为阳离子交换膜法电解饱和食盐水原理示意图,下列说法不正确的是( )

A.从E口逸出的气体是H2
B.从D口加入含少量NaOH的水溶液以增强导电性
C.标准状况下每生成22.4 L Cl2,便产生2 mol NaOH
D.粗盐水中含Ca2+、Mg2+、Fe3+、SO42-等离子,精制时先加Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以铅铁矿(主要成分为FeOCr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠 (Na2Cr2O72H2O),其主要反应为:
①4FeO Cr2O3 + 8Na2CO3 + 7O2 ![]() 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
②2Na2CrO4 + H2SO4 ![]() Na2SO4 + Na2Cr2O7 + H2O
Na2SO4 + Na2Cr2O7 + H2O
下列说法中正确的是
A.反应①和②均为氧化还原反应
B.反应①中FeO Cr2O3是还原剂,在反应中失去电子。
C.反应②中Na2CrO4发生氧化反应
D.生成l mol的CO2,反应①转移3.5 mol电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com