
【题目】某铝合金(硬铝)中含有铝、镁、铜、硅,为了测定该合金中铝的含量,有人设计了如下实验:
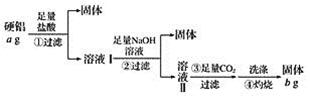
(1)溶液Ⅰ中的溶质为_________(填化学式,下同),溶液Ⅱ中的溶质为__________。
(2)上述第③步反应中,生成沉淀的离子方程式为____________。
(3)该合金中铝的含量为__________。
【答案】AlCl3、MgCl2、HCl Na[Al(OH)4]、NaCl、NaOH [Al(OH)4]-+CO2=Al(OH)3↓+HCO3— ![]()
【解析】
由测定该合金中铝的含量流程可知,①加盐酸,Cu、Si不反应,则过滤得到的固体为Cu、Si,溶液中含AlCl3、MgCl2以及过量的盐酸,②加足量的NaOH,过滤得到的沉淀为Mg(OH)2,溶液中主要含Na[Al(OH)4]、与过量盐酸反应生成的氯化钠和过量的氢氧化钠,③通足量的二氧化碳,反应生成Al(OH)3,④灼烧氢氧化铝分解得到Al2O3。
(1)根据分析可知溶液Ⅰ中的溶质为AlCl3、MgCl2、HCl;溶液Ⅱ中的溶质为Na[Al(OH)4]、NaCl、NaOH,故答案为:AlCl3、MgCl2、HCl;Na[Al(OH)4]、NaCl、NaOH;
(2)第③步通入二氧化碳与[Al(OH)4]-反应生成氢氧化铝沉淀,故答案为:[Al(OH)4]-+CO2=Al(OH)3↓+HCO3—;
(3)因铝在反应前后守恒,最后得到的固体Al2O3中铝的质量就是铝合金中的铝的质量,则铝的质量为![]() ,样品质量为ag,所以铝的质量分数=
,样品质量为ag,所以铝的质量分数=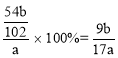 ,故答案为:
,故答案为:![]() 。
。


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】对于反应3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)的平衡常数,下列说法正确的是
Fe3O4(s)+4H2(g)的平衡常数,下列说法正确的是
A. K=![]()
B. K=![]()
C. 增大c(H2O)或减小c(H2),会使该反应平衡常数减小
D. 改变反应的温度,平衡常数不一定变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二〇〇八年北京残奥会吉祥物是以牛为形象设计的“福牛乐乐”(Funiulele)。有一种有机物的键线式也酷似牛,故称为牛式二烯炔醇(cowenynenynol)。已知连有四个不同的原子或原子团的碳原子,称为手性碳原子。下列有关说法不正确的是( )
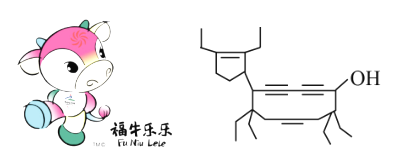
A.牛式二烯炔醇含有3种官能团,可以属于不饱和醇类
B.牛式二烯炔醇含有3个手性碳原子,与氢气完全加成反应后含有4个手性碳原子
C.1mol牛式二烯炔醇最多可与6molBr2发生加成反应
D.牛式二烯炔醇分子内能发生消去反应,也能发生催化氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如下能量关系示意图分析,下列说法正确的是

A. 1molC(g)与1molO2(g)的能量之和为393.5kJ
B. 反应2CO(g)+O2(g)=2CO2(g)中,反应物的总键能小于生成物的总键能
C. C→CO的热化学方程式为2C(s) +O2(g)=2CO(g) △H=-110.6kJ/mol
D. 热值是指一定条件下单位质量的物质完全燃烧所放出的热量,则CO的热值△H=10.1kJ/g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
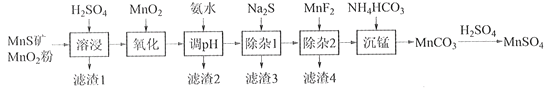
相关金属离子[c0(Mn+)=0.1 mol·L1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和__________________________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式____________________________________________________。
(2)“氧化”中添加适量的MnO2的作用是将________________________。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是_____________________________________________________________________。
(6)写出“沉锰”的离子方程式___________________________________________________。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnz2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=![]() 时,z=___________。
时,z=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物燃料电池在净化废水(含有Cr2O![]() 离子)的同时能获得能源或得到有价值的化学产品,图为其工作原理。下列说法正确的是( )
离子)的同时能获得能源或得到有价值的化学产品,图为其工作原理。下列说法正确的是( )
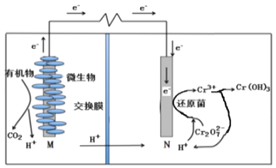
A.M为电源负极,有机物被还原
B.电池工作时,N极附近溶液pH减小
C.处理1molCr2O![]() 时有14molH+从交换膜左侧向右侧迁移
时有14molH+从交换膜左侧向右侧迁移
D.Cr2O![]() 离子浓度较大时,可能会造成还原菌失活
离子浓度较大时,可能会造成还原菌失活
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,利用培养皿探究NH3的性质。实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面。下表中对实验现象所做的解释正确的是( )

选项 | 实验现象 | 解释 |
A | 浓盐酸附近产生白烟 | NH3与浓盐酸反应产生了NH4Cl固体 |
B | 浓硫酸附近无明显现象 | NH3与浓硫酸不发生反应 |
C | 氯化物溶液变浑浊 | 该溶液一定是AlCl3溶液 |
D | 干燥红石蕊试纸不变色,湿润红石蕊试纸变蓝 | NH3是一种可溶性碱 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以白云石(主要成分为CaCO3和MgCO3)为原料制备氧化镁和轻质碳酸钙的一种工艺流程如下:
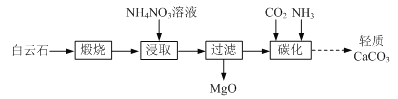
已知:Ksp[Mg(OH)2] = 5×1012
(1)白云石高温煅烧所得固体产物的主要成分为_______(填化学式)。
(2)NH4NO3溶液呈酸性的原因为_______(用离子方程式表示)。
(3)“浸取”后,c(Mg2+)应小于5×106 mol·L1,则需控制溶液pH ______。
(4)“碳化”反应的化学方程式为_______。
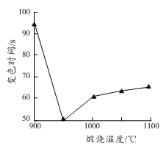
(5)煅烧所得固体的活性与其中CaO含量及固体疏松程度有关。其他条件相同时,将不同温度下的煅烧所得固体样品加入酸化的酚酞溶液中,引起溶液变色所需时间不同,由此可知煅烧所得固体的活性差异。溶液变色的时间与各样品煅烧温度的关系如图所示。当温度高于950 ℃时,煅烧所得固体易板结,活性降低;当温度低于950 ℃时,活性降低的原因为_______。将不同温度下的煅烧所得固体样品加入水中,也可测量其活性,则此时需测量的数据为相同时间后_______与样品煅烧温度之间的关系。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝和某些金属氧化物在高温下的置换反应称为“铝热反应”,比如:4Al+3MnO2![]() 2Al2O3+3Mn,下列有关说法错误的是
2Al2O3+3Mn,下列有关说法错误的是
A.该反应为置换反应
B.反应中氧化剂为MnO2,氧化产物为Mn
C.从反应可以比较还原性:Al强于Mn
D.反应中生成1mol Al2O3时,转移的电子数为6NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com