
【题目】微生物燃料电池在净化废水(含有Cr2O![]() 离子)的同时能获得能源或得到有价值的化学产品,图为其工作原理。下列说法正确的是( )
离子)的同时能获得能源或得到有价值的化学产品,图为其工作原理。下列说法正确的是( )
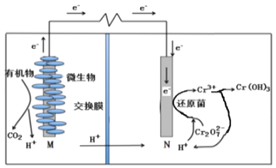
A.M为电源负极,有机物被还原
B.电池工作时,N极附近溶液pH减小
C.处理1molCr2O![]() 时有14molH+从交换膜左侧向右侧迁移
时有14molH+从交换膜左侧向右侧迁移
D.Cr2O![]() 离子浓度较大时,可能会造成还原菌失活
离子浓度较大时,可能会造成还原菌失活
【答案】D
【解析】
原电池装置图中H+向右移动,则N电极为正极,发生得到电子的还原反应,Cr2O72-得电子生成Cr3+,电极反应式为Cr2O72-+6e-+14H+=2Cr3++7H2O,M极失电子发生氧化反应,有机物被氧化生成CO2,为原电池的负极,以此解答该题。
A.根据分析,M为电源负极,有机物被氧化,A选项错误;
B.根据图示,正极反应为Cr2O72-+6e-+14H+=2Cr3++7H2O,消耗氢离子,N极附近溶液pH增大,B选项错误;
C.Cr元素由+6价变为+3价,处理1mol![]() 时转移6mol电子,所以至少有6molH+从交换膜左侧移向右侧,C选项错误;
时转移6mol电子,所以至少有6molH+从交换膜左侧移向右侧,C选项错误;
D.Cr2O72-具有强氧化性,能使蛋白质变性,浓度较大时,可能会造成还原菌失活,D选项正确;
答案选D。


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
【题目】(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示___________,K值大小与温度的关系是:温度升高,K值_________(填一定增大、一定减小、或可能增大也可能减小)。
(2)对于可逆反应CO(g) +H2O(g) ![]() CO2(g)+H2(g) △H<0在850℃时,KC=1 该反应的平衡常数K的表达式为K=______;若温度为900℃,达到平衡后KC_____1 (填“>“<”=)
CO2(g)+H2(g) △H<0在850℃时,KC=1 该反应的平衡常数K的表达式为K=______;若温度为900℃,达到平衡后KC_____1 (填“>“<”=)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了验证卤素单质氧化性的相对强弱,某小组用如图所示装置进行实验(夹 持仪器已略去,气密性已检验)。

实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹.。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.…
(1)A中反应的化学方程式为:KMnO4+HCl(浓)=KCl+MnCl2+Cl2↑+H2O,则氧化性KMnO4____Cl2(填“>”“<”或“=”)。
(2)验证氯气的氧化性强于碘的实验现象是____。
(3)过程Ⅲ的实验目的是____。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是____。
(5)浸有NaOH溶液的棉花团的作用是____。此处发生的化学方 程式是____。
(6)氰(CN)2、硫氰(SCN)2的化学性质和卤素很相似,化学上称为“类卤素”,它们单质氧化性强弱为:Cl2>Br2>(CN)2>(SCN)2>I2。试写出:在NaBr和KSCN的混合溶液中加入(CN)2的化学方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯酰胺是一种重要的有机合成的中间体。它的球棍模型如图所示:(图中“棍”代表单键或双键或三键,不同颜色球表示不同原子:C、H、O、N)

(1)丙烯酰胺的分子式为___,结构简式为___。
(2)有关丙烯酰胺的说法正确的是___。
A.丙烯酰胺分子内所有原子不可能在同一平面内
B.丙烯酰胺属于烃的含氧衍生物
C.丙烯酰胺能够使酸性高锰酸钾溶液褪色
D.丙烯酰胺能够使溴的四氯化碳溶液褪色
(3)工业上生产丙烯酰胺可以用下面的反应(反应均在一定条件下进行):
CH![]() CH
CH![]() CH2=CHCN
CH2=CHCN![]() 丙烯酰胺
丙烯酰胺
假设反应Ⅰ和反应Ⅱ都是原子利用率100%的反应,反应Ⅰ所需另一反应物的分子式为___,反应Ⅱ的方程式为___。
(4)聚丙烯酰胺(PAM)是一种合成有机高分子絮凝剂,写出由丙烯酰胺合成聚丙烯酰胺的化学方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铝合金(硬铝)中含有铝、镁、铜、硅,为了测定该合金中铝的含量,有人设计了如下实验:
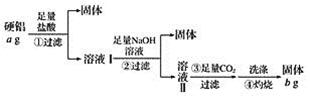
(1)溶液Ⅰ中的溶质为_________(填化学式,下同),溶液Ⅱ中的溶质为__________。
(2)上述第③步反应中,生成沉淀的离子方程式为____________。
(3)该合金中铝的含量为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是危害最为严重的大气污染物之一,SO2的含量是衡量大气污染的一个重要指标。工业上常采用催化还原法或吸收法处理SO2。催化还原SO2不仅可以消除SO2污染,而且可得到有价值的单质S。
(1)在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2 和H2O。已知CH4和S的燃烧热分别为890.3kJ/mol和297.2kJ/mol,CH4和SO2反应的热化学方程式为________________。
(2)用H2还原SO2生成S的反应分两步完成,如图1所示,该过程中相关物质的物质的量浓度随时间的变化关系如图2所示:
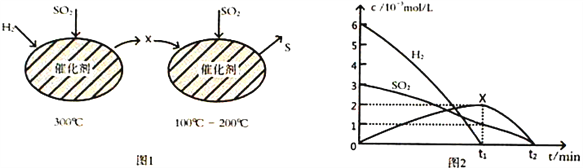
①分析可知X为____________(写化学式),0~t1时间段的温度为_________________,0~t1时间段用SO2 表示的化学反应速率为________________________________。
②总反应的化学方程式为_______________________________。
(3)焦炭催化还原SO2生成S2,化学方程式为:2C(s)+2SO2(g)![]() S2(g)+2CO2(g),恒容容器中,lmol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。
S2(g)+2CO2(g),恒容容器中,lmol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。
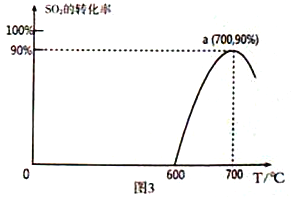
①该反应的ΔH_______________0 (填“>”或“<”)。
②计算a点的平衡常数为_______________________。
(4)工业上可用Na2SO3溶液吸收SO2,该反应的离子方程式为__________________________,25℃时用1mol/L的Na2SO3溶液吸收SO2,当溶液pH=7时,溶液中各离子浓度的大小关系为__________________。已知:H2SO3的电离常数K1=1.3×10-2,K2=6.2×10-8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全球气候变暖给人类的生存和发展带来了严峻的挑战,在此背景下,“新能源”、“低碳”、“节能减排”、“吃干榨尽”等概念愈来愈受到人们的重视。下列有关说法不正确的是
A. 太阳能、地热能、生物质能和核聚变能均属于“新能源”
B. “低碳”是指采用含碳量低的烃类作为燃料
C. 如图甲烷经一氯甲烷生成低碳烯烃的途径体现了“节能减排”思想

D. 让煤变成合成气,把煤“吃干榨尽”,实现了煤的清洁、高效利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下进行下列实验,根据实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 室温下,向苯酚钠溶液中通足量CO2,溶液变浑浊 | 碳酸的酸性比苯酚的强 |
B | 加热乙醇与浓硫酸的混合溶液,将产生的气体通入少量酸性KMnO4溶液,溶液紫红色褪去 | 有乙烯生成 |
C | 向5 mL 0.1 mol·L1 KI溶液中加入1 mL 0.1 mol·L1 FeCl3溶液,充分反应后,萃取分液,向水层中滴加KSCN溶液,溶液呈血红色 | I-与Fe3+的反应有一定限度 |
D | 向NaHCO3溶液中滴加紫色石蕊试液,溶液变蓝 | Kw<Ka1(H2CO3)×Ka2(H2CO3) |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
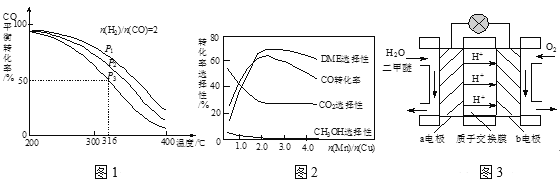
【题目】二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H 1=-90.7 kJ·mol-1 K1
CH3OH(g) △H 1=-90.7 kJ·mol-1 K1
②2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1 K2
CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1 K2
③CO(g)+H2O(g)![]() CO2(g)+H2(g) △H 3=-41.2kJ·mol-1 K3
CO2(g)+H2(g) △H 3=-41.2kJ·mol-1 K3
回答下列问题:
(1)则反应3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)的△H=____kJ·mol-1;该反应的平衡常数K=____(用K1、K2、K3表示)
CH3OCH3(g)+CO2(g)的△H=____kJ·mol-1;该反应的平衡常数K=____(用K1、K2、K3表示)
(2)下列措施中,能提高CH3OCH3产率的有____。
A.使用过量的CO B.升高温度 C.增大压强
(3)将合成气以n(H2)/n(CO)=2通入1 L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是____。
CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是____。
A.△H <0
B.P1>P2>P3:
C.若在P3和316℃时,起始时n(H2)/n(CO)=3,则达到平衡时,CO转化率小于50%
(4)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚。观察图2回答问题。催化剂中n(Mn)/n(Cu)约为____时最有利于二甲醚的合成。
(5)图3为绿色电源“二甲醚燃料电池”的工作原理示意图,a电极的电极反应式为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com