
【题目】(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示___________,K值大小与温度的关系是:温度升高,K值_________(填一定增大、一定减小、或可能增大也可能减小)。
(2)对于可逆反应CO(g) +H2O(g) ![]() CO2(g)+H2(g) △H<0在850℃时,KC=1 该反应的平衡常数K的表达式为K=______;若温度为900℃,达到平衡后KC_____1 (填“>“<”=)
CO2(g)+H2(g) △H<0在850℃时,KC=1 该反应的平衡常数K的表达式为K=______;若温度为900℃,达到平衡后KC_____1 (填“>“<”=)
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
【题目】吉林某化工厂发生爆炸,导致1个硝基苯储罐、2个苯储罐报废,导致苯酚、苯胺停产。爆炸过程还产生了大量的浓烟和强烈的刺激性气味,造成了空气污染。
(1)写出上述材料中提到的4种有机物中,任意两种有机物的结构简式①_______,②_________。
(2)爆炸过程中,产生了大量黑烟,其原因是_____________
(3)上述爆炸事故附近的江水有强烈苦杏仁气味,苯、硝基苯、二甲苯等主要污染物指标均超过国家标准。具有苦杏仁味的有机物是________,它在江水中的主要存在形式是___________。
(4)硝基苯是制造染料的重要原料,但是硝基苯进入人体,严重危害人体健康,写出实验室由苯制取硝基苯反应的化学方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸、碱、盐都是电解质,在水中都能电离出离子。根据下列化合物:①NaOH ②CH3COOH ③NH4Cl ④NH3·H2O ⑤CH3COONa,请回答下列问题:
(1)上述几种电解质中属于弱电解质的是______________
(2)常温下pH=2的CH3COOH溶液中由水电离产生的 c(OH-) =_____________________
(3)写出CH3COOH的电离方程式_______________________
(4)将等pH等体积的NaOH和NH3·H2O分别稀释m倍和n倍,稀释后两溶液的pH仍相等,则m ___________n (填“大于、等于或小于”)
(5)pH=12的NaOH溶液100mL,要使它的pH为11,如果加0.01mol/L HCl,应加_______mL。(体积变化忽略不计)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组设计用50mL1.0 mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在如图装置中进行中和反应。在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过。通过测定反应过程中所放出的热量可计算中和热。试回答下列问题:
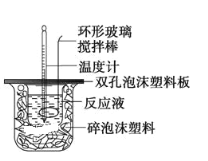
(1)本实验中用稍过量的NaOH的原因教材中说是为保证盐酸完全被中和。试问:盐酸在反应中若因为有放热现象,而造成少量盐酸在反应中挥发,则测得的中和热___(填“偏大”“偏小”或“不变”)。
(2)该实验小组做了三次实验,每次取溶液各50 mL,并记录如下原始数据。
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | 温差(t2-t1)/℃ | ||
盐酸 | NaOH溶液 | 平均值 | |||
1 | 24.8 | 25.2 | 25.0 | 31.6 | 6.6 |
2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
3 | 25.2 | 25.0 | 25.1 | 31.9 | 6.8 |
已知盐酸、NaOH溶液密度近似为1.00g/cm3,中和后混合液的比热容c=4.18×10-3 kJ/(g·℃),混合后溶液质量为m,反应放出的热量Q=cm△t,则该反应生成水的物质的量为____,中和热为ΔH=____。
(3)若用等浓度的盐酸与NH3·H2O溶液反应,则测得的中和热会___(填“偏大”“偏小”或“不变”),其原因是____。
(4)在中和热测定实验中存在用水洗涤温度计上的盐酸溶液的步骤,若无此操作步骤,则测得的中和热____(填“偏大”“偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)的平衡常数,下列说法正确的是
Fe3O4(s)+4H2(g)的平衡常数,下列说法正确的是
A. K=![]()
B. K=![]()
C. 增大c(H2O)或减小c(H2),会使该反应平衡常数减小
D. 改变反应的温度,平衡常数不一定变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列溶液中,各组离子一定能够大量共存的是 ( )
A.使酚酞试液变红的溶液:Na+、Cl-、SO42-、Fe3+
B.使紫色石蕊试液变红的溶液:Fe3+、Mg2+、NO![]() 、Cl-
、Cl-
C.某无色的溶液:K+、Ba2+、Cl-、MnO4-
D.碳酸氢钠溶液:K+、SO42-、Cl-、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容的密闭容器中,发生可逆反应2NO(g)+O2(g)![]() 2NO2(g),不能说明该反应已经达到平衡状态的是
2NO2(g),不能说明该反应已经达到平衡状态的是
A. 正反应生成NO2的速率和逆反应生成NO的速率相等
B. 反应容器中压强不随时间的延长而变化
C. 混合气体颜色深浅保持不变
D. 混合气体的密度不随时间延长而变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体化合物X由5种元素组成。某学习小组进行了如下实验:
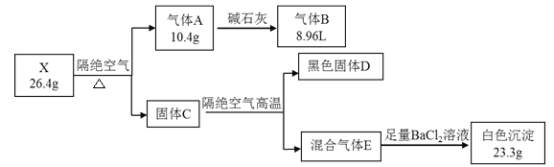
已知气体B能使湿润红色石蕊试纸变蓝。请回答:
(1)X中含有的元素有_____________,X的化学式_____________。
(2)X的水溶液可以与纤维素作用,工业上利用此性质得到产物名称_____________。
(3)写出X隔绝空气强热生成A、D、E的化学方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物燃料电池在净化废水(含有Cr2O![]() 离子)的同时能获得能源或得到有价值的化学产品,图为其工作原理。下列说法正确的是( )
离子)的同时能获得能源或得到有价值的化学产品,图为其工作原理。下列说法正确的是( )
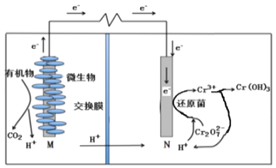
A.M为电源负极,有机物被还原
B.电池工作时,N极附近溶液pH减小
C.处理1molCr2O![]() 时有14molH+从交换膜左侧向右侧迁移
时有14molH+从交换膜左侧向右侧迁移
D.Cr2O![]() 离子浓度较大时,可能会造成还原菌失活
离子浓度较大时,可能会造成还原菌失活
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com