
【题目】在下列溶液中,各组离子一定能够大量共存的是 ( )
A.使酚酞试液变红的溶液:Na+、Cl-、SO42-、Fe3+
B.使紫色石蕊试液变红的溶液:Fe3+、Mg2+、NO![]() 、Cl-
、Cl-
C.某无色的溶液:K+、Ba2+、Cl-、MnO4-
D.碳酸氢钠溶液:K+、SO42-、Cl-、OH-
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】有甲、乙、丙三个体积均为2L的恒容密闭容器,按不同投料比Z[![]() 进行反应: 4HCl(g)+O2(g)
进行反应: 4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g) △H。在不同温度T条件下达到平衡时,HCl的平衡转化率与Z和T的关系如下表所示。
2Cl2(g)+2H2O(g) △H。在不同温度T条件下达到平衡时,HCl的平衡转化率与Z和T的关系如下表所示。
容器 | 起始时 | 平衡时HCl转化率 | |||
n(HCl)/mol | Z | T=100℃ | T=200℃ | T=300℃ | |
甲 | 0.8 | a | 96% | 94% | 90% |
乙 | 0.8 | b | 46% | 44% | 40% |
丙 | 0.8 | 4 | 95% | 88% | 80% |
下列说法正确的是
A.b<4
B.温度升高时,反应速率减慢,所以转化率下降
C.丙容器中,300℃平衡时,c(O2)=0.04molL-1
D.若甲容器温度在300时需要5min达到平衡,则此时间内v(Cl2)=0.036molL-1min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.H2(g)+I2(g)![]() 2HI(g),平衡后,减压平衡不移动,气体颜色不变
2HI(g),平衡后,减压平衡不移动,气体颜色不变
B.H2(g)+I2(g)![]() 2HI(g),平衡后,加压平衡不移动,气体颜色不变
2HI(g),平衡后,加压平衡不移动,气体颜色不变
C.2NO2(g)![]() N2O4(g),平衡后,加压平衡正向移动,气体颜色变浅
N2O4(g),平衡后,加压平衡正向移动,气体颜色变浅
D.2NO2(g)![]() N2O4(g),平衡后,加压平衡正向移动,气体颜色先变深后变浅
N2O4(g),平衡后,加压平衡正向移动,气体颜色先变深后变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.Ca(OH)2![]() Ca(ClO)2(aq)
Ca(ClO)2(aq)![]() HClO(aq)
HClO(aq)
B.Fe(s)![]() Fe2O3(s)
Fe2O3(s)![]() FeCl3(aq)
FeCl3(aq)
C.S(s)![]() SO2(g)
SO2(g)![]() BaSO3(s)
BaSO3(s)
D.NH3(g)![]() NO(g)
NO(g)![]() HNO3(aq)
HNO3(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示___________,K值大小与温度的关系是:温度升高,K值_________(填一定增大、一定减小、或可能增大也可能减小)。
(2)对于可逆反应CO(g) +H2O(g) ![]() CO2(g)+H2(g) △H<0在850℃时,KC=1 该反应的平衡常数K的表达式为K=______;若温度为900℃,达到平衡后KC_____1 (填“>“<”=)
CO2(g)+H2(g) △H<0在850℃时,KC=1 该反应的平衡常数K的表达式为K=______;若温度为900℃,达到平衡后KC_____1 (填“>“<”=)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物X,含有NaClO3、KCl、NaOH、ZnSO4、NaAl(OH)4和NaNO2中的几种,进行如下实验:①X溶于水,得到溶液Y;②溶液Y先加入过量稀HNO3酸化,再加入AgNO3溶液,得到白色沉淀W,下列说法不正确的是( )
A.混合物X中可能含有KCl
B.向溶液Y中滴加盐酸,若产生白色沉淀,说明X中一定含有NaAl(OH)4
C.向溶液Y中滴加盐酸,若产生红棕色的气体,说明X中一定含有NaNO2
D.取X溶液进行焰色反应,透过蓝色钴玻璃片没有观察到紫色火焰,说明X中一定含有NaClO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示三套实验装置,分别回答下列问题。
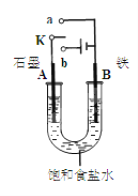
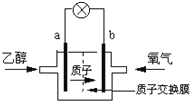
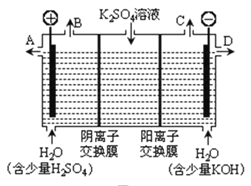
图1图2图3
(1)图1中,① 若开始时开关K与a连接,则该装置为_____(填装置名称),电极A的电极反应式为________________________
②若开始时开关K与b连接,则总反应的离子方程式为 ___________________________
(2)2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200°C左右时供电,电池示意如图2所示:
①______极(填a或b)为电池的正极,电池工作时电流方向为_________(填a→b或b→a)
②写出该电池负极的电极反应式________________________________________
(3)用图3装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾(电解槽内的阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)。
①该电解槽的阴极反应式为_____________________。
②制得的硫酸溶液从出口____(填“A”、“D”)导出,并简述原因__________________________(请用化学用语和文字解释)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】核磁共振造影增强剂用于疾病的诊断,还可以作为药物载体用于疾病的治疗。中科院化学研究所在肿瘤鉴别诊断用磁共振造影剂研究方面取得重要进展。为磁性纳米晶体材料在生物医学领域的应用提供了更广泛的前景。制备纳米四氧化三铁过程如图:

下列有关叙述不合理的是( )
A.纳米四氧化三铁具有磁性作为药物载体用于疾病的治疗
B.反应③的化学方程式是:6FeOOH+CO=2Fe3O4+3H2O+CO2
C.在反应②环丙胺的作用可能是促进氯化铁水解
D.纳米四氧化三铁分散在适当溶剂中,它与溶液分散质直径相当
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是危害最为严重的大气污染物之一,SO2的含量是衡量大气污染的一个重要指标。工业上常采用催化还原法或吸收法处理SO2。催化还原SO2不仅可以消除SO2污染,而且可得到有价值的单质S。
(1)在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2 和H2O。已知CH4和S的燃烧热分别为890.3kJ/mol和297.2kJ/mol,CH4和SO2反应的热化学方程式为________________。
(2)用H2还原SO2生成S的反应分两步完成,如图1所示,该过程中相关物质的物质的量浓度随时间的变化关系如图2所示:
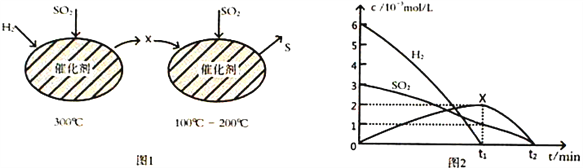
①分析可知X为____________(写化学式),0~t1时间段的温度为_________________,0~t1时间段用SO2 表示的化学反应速率为________________________________。
②总反应的化学方程式为_______________________________。
(3)焦炭催化还原SO2生成S2,化学方程式为:2C(s)+2SO2(g)![]() S2(g)+2CO2(g),恒容容器中,lmol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。
S2(g)+2CO2(g),恒容容器中,lmol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。
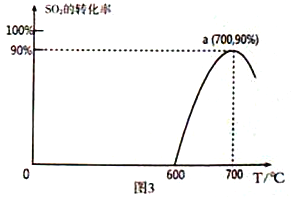
①该反应的ΔH_______________0 (填“>”或“<”)。
②计算a点的平衡常数为_______________________。
(4)工业上可用Na2SO3溶液吸收SO2,该反应的离子方程式为__________________________,25℃时用1mol/L的Na2SO3溶液吸收SO2,当溶液pH=7时,溶液中各离子浓度的大小关系为__________________。已知:H2SO3的电离常数K1=1.3×10-2,K2=6.2×10-8
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com