
����Ŀ����ͼ��ʾ����ʵ��װ�ã��ֱ�ش��������⡣
ͼ1ͼ2ͼ3
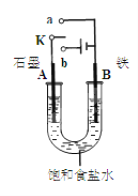
��1��ͼ1�У��� ����ʼʱ����K��a���ӣ����װ��Ϊ_____����װ�����ƣ����缫A�ĵ缫��ӦʽΪ________________________
������ʼʱ����K��b���ӣ����ܷ�Ӧ�����ӷ���ʽΪ ___________________________
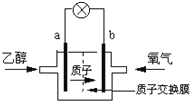
��2��2004������ʥ·��˹��ѧ������һ�����͵��Ҵ���أ����û����������ܼ�����200��C����ʱ���磬���ʾ����ͼ2��ʾ��
��______������a��b��Ϊ��ص���������ع���ʱ��������Ϊ_________����a��b��b��a��
��д���õ�ظ����ĵ缫��Ӧʽ________________________________________
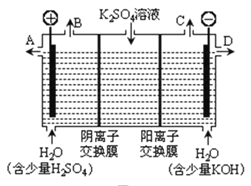
��3����ͼ3װ�õ���������Һ����ȡ������������������������أ������ڵ������ӽ���Ĥֻ����������ͨ���������ӽ���Ĥֻ����������ͨ������
�ٸõ��۵�������ӦʽΪ_____________________��
���Ƶõ�������Һ�ӳ���____���A������D��������,������ԭ��__________________________(���û�ѧ��������ֽ���)
���𰸡� ԭ��� 2H2O��O2��4e����4OH�� 2H2O��2Cl-![]() 2OH����H2����Cl2�� b b��a C2H5OH-12e��+3H2O��12H++2CO2 2H2O��2e����2OH����H2�� ��2H+��2e����H2�� A 2H2O-4e����4H+��O2��,OH���������ŵ磬ʹˮ�ĵ���ƽ�������ƶ��� c(H+)����SO42-ͨ�������ӽ���Ĥ������������H+��ϳ�����
2OH����H2����Cl2�� b b��a C2H5OH-12e��+3H2O��12H++2CO2 2H2O��2e����2OH����H2�� ��2H+��2e����H2�� A 2H2O-4e����4H+��O2��,OH���������ŵ磬ʹˮ�ĵ���ƽ�������ƶ��� c(H+)����SO42-ͨ�������ӽ���Ĥ������������H+��ϳ�����
�����������⿼��绯ѧ����1��ͼ1�У�����K��a�����γ�ԭ��ط�Ӧ������������ʴ��A�缫ʯī��������Һ�������õ������������������ӣ��缫��ӦΪ��O2+2H2O+4e��=4OH�����ڿ���K��b���ӣ�װ��Ϊ���أ�ʯī����������Ϊ�������൱�ڵ�ⱥ��ʳ��ˮ�����������ơ�����������������ܷ�Ӧ�����ӷ���ʽΪ2Cl��+2H2O![]() 2OH��+H2��+Cl2������2����ȼ�ϵ���У�ȼ���Ҵ��ڸ���(a��)����ʧ���ӵķ�Ӧ��������������(b��)�Ϸ����õ��ӵķ�Ӧ�������ڵ�·�д�������������b��a���ڸõ�ظ����ĵ缫��ӦʽΪ��C2H5OH+3H2O��12e��=2CO2+12H+����3���ٵ��ʱ�������������ӵõ��ӷ�����ԭ��Ӧ���缫��ӦʽΪ��2H++2e��=H2����2H2O��2e����2OH����H2������������ʧ���ӷ���������Ӧ����Һ�е����������ӵķŵ�����������������ӵķŵ���������������������������ʧ��������ˮ������4OH����4e��=2H2O+O2����OH���������ŵ磬�������������������ƶ����õ缫�ϻ�������ᣬ���������ӷŵ磬��˼������������ƶ����������������������������ɣ���������������Һ�ӳ���D�������Ƶõ�������Һ��A��������
2OH��+H2��+Cl2������2����ȼ�ϵ���У�ȼ���Ҵ��ڸ���(a��)����ʧ���ӵķ�Ӧ��������������(b��)�Ϸ����õ��ӵķ�Ӧ�������ڵ�·�д�������������b��a���ڸõ�ظ����ĵ缫��ӦʽΪ��C2H5OH+3H2O��12e��=2CO2+12H+����3���ٵ��ʱ�������������ӵõ��ӷ�����ԭ��Ӧ���缫��ӦʽΪ��2H++2e��=H2����2H2O��2e����2OH����H2������������ʧ���ӷ���������Ӧ����Һ�е����������ӵķŵ�����������������ӵķŵ���������������������������ʧ��������ˮ������4OH����4e��=2H2O+O2����OH���������ŵ磬�������������������ƶ����õ缫�ϻ�������ᣬ���������ӷŵ磬��˼������������ƶ����������������������������ɣ���������������Һ�ӳ���D�������Ƶõ�������Һ��A��������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й���������ʵ�����������ȷ����
A.���ڿ�����ȼ�գ����ɵ���ɫ��������
B.����һ��ǿ��ԭ���������Ѵ�������Һ���û�����
C.�����ȵ�ͭ˿����ʢ�������ļ���ƿ�У������ػ�ɫ����
D.Fe(OH)3������������ԣ�������ˮ�е�������������������������ھ�ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����MgCl2��KCl��Na2SO4�������ʵĻ��Һ�У���֪���к�Cl��1.5 mol��K����Na����1.5 mol��Mg2��Ϊ0.5 mol����SO42-�����ʵ���Ϊ�� ��
A.1 molB.0.5 molC.0.25 molD.0.15 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ָ����Ӧ�����ڷ���ʽ��ȷ����
A. ���Ȼ�����Һ�еμӹ�����ˮ:Al3++4NH3��H2O=AlO2-+4NH4++2H2O
B. Ũ������MnO2��Ӧ��ȡCl2:MnO2+4HCl(Ũ) ![]() Mn2++2Cl-+Cl2��+2H2O
Mn2++2Cl-+Cl2��+2H2O
C. ���������£��⻯����Һ¶���ڿ����б���:4H++4I-+O2=2I2+2H2O
D. ��Ca(HCO3)2��Һ�м�������Ca(OH)2��Һ:HCO3-+OH-=CO32-+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����50mL18molL��1��ŨH2SO4�м���������CuƬ�����ȣ���ַ�Ӧ����ԭ��H2SO4�����ʵ���Ϊ�� ��
A. ����0.9mol B. ����0.45mol C. ����0.45mol����0.9mol D. ��0.45mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ���������ֵ������˵����ȷ����
A. 1mol����ϩ�к�̼̼˫����Ϊ4NA
B. ʢ��SO2���ܱ������к���NA����ԭ�ӣ���SO2�����ʵ���Ϊ0.5mol
C. ��״������2.24LCl2����ˮ��ת��6.02��1022������
D. 1L0.1molL-1�İ�ˮ����0.1NA��NH4+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ȼ��ƺ������Ϊԭ���Ʊ��Ȼ�識�����Ʒ�����ƵĹ����������£�
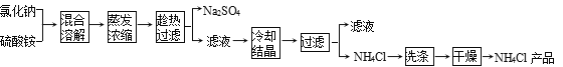
���������ϡ�
������������ʾ������ֻ��NH4Cl�����ֽ⣺NH4Cl![]() NH3��+HCl��
NH3��+HCl��
���Ȼ�狀������Ƶ��ܽ�����¶ȱ仯��������ͼ��ʾ��
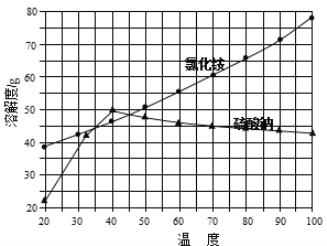
��ش��������⣺
��1��д���Ȼ��ƺ��������Һ��ϵõ������ƾ���Ļ�ѧ����ʽ�� ��
��2�����Ʊ�10.7 g NH4Cl����������NaCl����Ϊ g��
��3��ʵ���ҽ��������ᾧ�õ�����Ҫ����������̨����Ȧ���ƾ����⣬��Ҫ�� ��
��4������ȴ�ᾧ�������У�����NH4Cl����ĺ����¶�Ϊ ��
��5�����������Լ������NH4Cl��Ʒ�Ƿ��ķ�����
�������� | ���� | ���� |
ȡ�����Ȼ�鱗�Ʒ���Թܵײ��� | �����Ȼ�鱗�Ʒ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����ṩ��ͼ1��ʾ������������ء�ʯ��ʯ���������̡�ϡ���ᡢ��������ҩƷ��������Ӧ��Ʒ��

��1��д����������������ҩƷ���û�ѧ����ʽ��ʾ��ȡ������Ļ�ѧ��Ӧԭ��________������ȡ�����������ʵ���������Ҫ�õ��������У���������ţ�________��
��2�������ͼ2��ʾ�����������������ͬѧ�ǽ�ͼ����������
��3��ͼ���ô˷����ռ�����ʱ��֤�������强���ռ�����������________��
��4��ʵ�������Ҫ��________��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ȩ����Ҫ��ҽҩԭ�ϣ�Ҳ����Ҫ�����ϣ���ṹ��ʽ����ͼ��ʾ��

��1�����ȩ�ķ���ʽ��_____________________��
��2�����ȩ���������ŵ�������___________________��___________________��
��3�����ȩ������Cu(OH)2��Ӧ�Ļ�ѧ����ʽ��________________________________��
��4��1 mol���ȩ��H2��ȫ��Ӧ���������H2�����ʵ�����________mol��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com