
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.Ca(OH)2![]() Ca(ClO)2(aq)
Ca(ClO)2(aq)![]() HClO(aq)
HClO(aq)
B.Fe(s)![]() Fe2O3(s)
Fe2O3(s)![]() FeCl3(aq)
FeCl3(aq)
C.S(s)![]() SO2(g)
SO2(g)![]() BaSO3(s)
BaSO3(s)
D.NH3(g)![]() NO(g)
NO(g)![]() HNO3(aq)
HNO3(aq)
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
(1)在一容积为2L的密闭容器内,充入0.2molCO与0.4molH2发生反应,CO(g)+2H2(g)![]() CH3OH(g),CO的平衡转化率与温度,压强的关系如图所示。
CH3OH(g),CO的平衡转化率与温度,压强的关系如图所示。
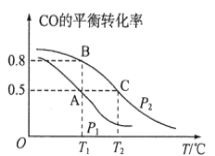
①A、B两点对应的压强大小关系是PA________PB(填“>、<、=”)。
②A、B、C三点的平衡常数KA,KB,KC的大小关系是__________________。
③下列叙述能说明上述反应能达到化学平衡状态的是__________________(填代号) 。
a.H2的消耗速率是CH3OH生成速率的2倍
b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变
d.CO和CH3OH的物质的量之和保持不变
(2)在P1压强、T1℃时,该反应的平衡常数K=__________________,再加入1.0molCO后重新到达平衡,则CO的转化率___________(填“增大,不变或减小”)。
(3)T1℃、1L的密闭容器内发生上述反应,测得某时刻各物质的物质的量如下,CO:0.1mol、H2:0.2mol、CH3OH:0.2mol。此时v(正)________v(逆)(填“>、<或=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(7分)某含有一个双键的气态烯烃和另一气态烷烃的混合气体,在同温同压下其密度是H2的13.2倍。在标准状况下将4.48L混合气体通过足量的溴水,结果溴水增重3.36g,求原混合气体中各烃的体积分数。 (注:此题必须写出过程,否则不得分)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质在水中的电离方程式书写正确的是( )
A.H2CO3![]() 2H++CO32-B.Al(OH)3=Al3+ +3OH-
2H++CO32-B.Al(OH)3=Al3+ +3OH-
C.NH3·H2O![]() NH4+ +OH-D.NaHSO4=Na++HSO4-
NH4+ +OH-D.NaHSO4=Na++HSO4-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组设计用50mL1.0 mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在如图装置中进行中和反应。在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过。通过测定反应过程中所放出的热量可计算中和热。试回答下列问题:
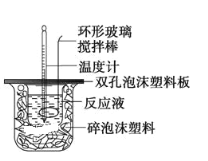
(1)本实验中用稍过量的NaOH的原因教材中说是为保证盐酸完全被中和。试问:盐酸在反应中若因为有放热现象,而造成少量盐酸在反应中挥发,则测得的中和热___(填“偏大”“偏小”或“不变”)。
(2)该实验小组做了三次实验,每次取溶液各50 mL,并记录如下原始数据。
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | 温差(t2-t1)/℃ | ||
盐酸 | NaOH溶液 | 平均值 | |||
1 | 24.8 | 25.2 | 25.0 | 31.6 | 6.6 |
2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
3 | 25.2 | 25.0 | 25.1 | 31.9 | 6.8 |
已知盐酸、NaOH溶液密度近似为1.00g/cm3,中和后混合液的比热容c=4.18×10-3 kJ/(g·℃),混合后溶液质量为m,反应放出的热量Q=cm△t,则该反应生成水的物质的量为____,中和热为ΔH=____。
(3)若用等浓度的盐酸与NH3·H2O溶液反应,则测得的中和热会___(填“偏大”“偏小”或“不变”),其原因是____。
(4)在中和热测定实验中存在用水洗涤温度计上的盐酸溶液的步骤,若无此操作步骤,则测得的中和热____(填“偏大”“偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以锈蚀程度很大的废铁屑为原料制备FeCl3·6H2O晶体的流程可简要表示如下:
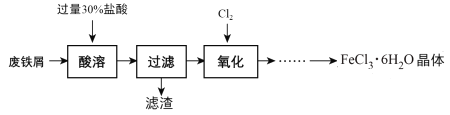
已知:在水溶液中Fe2+能与K3Fe(CN)6生成蓝色沉淀Fe3[Fe(CN)6]2。
试回答下列问题:
(1)“酸溶”过程中发生主要反应有:
①Fe +2H+=Fe2++H2↑;②Fe2O3+ 6H+=2Fe3++3H2O;③___。(用离子方程式表示)
(2)“酸溶”需控制温度在40℃左右,最佳的加热方式是____。
(3)“过滤”需要的玻璃仪器除烧杯外还有___。
(4)“氧化”过程可在如图所示装置中进行。
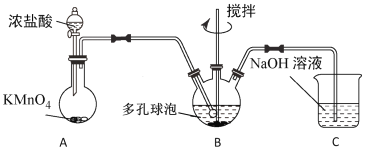
①装置A中KMnO4与浓盐酸反应生成MnCl2和Cl2,其离子方程式为___。
②装置C的作用是____。
③为使Cl2能充分发生反应,除在B中使用多孔球泡和搅拌外,实验中可采取的措施是___。
④证明装置B溶液中Fe2+已完全被氧化成Fe3+的实验方案是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列溶液中,各组离子一定能够大量共存的是 ( )
A.使酚酞试液变红的溶液:Na+、Cl-、SO42-、Fe3+
B.使紫色石蕊试液变红的溶液:Fe3+、Mg2+、NO![]() 、Cl-
、Cl-
C.某无色的溶液:K+、Ba2+、Cl-、MnO4-
D.碳酸氢钠溶液:K+、SO42-、Cl-、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水热法制备Fe3O4纳米颗粒的反应为:3Fe2++2S2O32-+O2+xOH-=Fe3O4+S4O62-+2H2O,下列说法中,不正确的是( )
A.x=4
B.每生成1molFe3O4,反应转移的电子总数为3mol
C.1molFe2+被氧化时,被Fe2+还原的O的物质的量为0.25mol
D.可以通过丁达尔效应判断有无Fe3O4纳米颗粒生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钾玻璃中含有18.4%的K2O,11.0%的CaO,70.6%的SiO2。
(1)计算三种氧化物的物质的量之比_________。
(2)若需制造5.1 t 钾玻璃,需用碳酸钾、石灰石、石英各_________吨?
(3)生产过程中释放出_________吨温室气体二氧化碳?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com