
【题目】全球气候变暖给人类的生存和发展带来了严峻的挑战,在此背景下,“新能源”、“低碳”、“节能减排”、“吃干榨尽”等概念愈来愈受到人们的重视。下列有关说法不正确的是
A. 太阳能、地热能、生物质能和核聚变能均属于“新能源”
B. “低碳”是指采用含碳量低的烃类作为燃料
C. 如图甲烷经一氯甲烷生成低碳烯烃的途径体现了“节能减排”思想

D. 让煤变成合成气,把煤“吃干榨尽”,实现了煤的清洁、高效利用
科目:高中化学 来源: 题型:
【题目】在恒温恒容的密闭容器中,发生可逆反应2NO(g)+O2(g)![]() 2NO2(g),不能说明该反应已经达到平衡状态的是
2NO2(g),不能说明该反应已经达到平衡状态的是
A. 正反应生成NO2的速率和逆反应生成NO的速率相等
B. 反应容器中压强不随时间的延长而变化
C. 混合气体颜色深浅保持不变
D. 混合气体的密度不随时间延长而变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如下能量关系示意图分析,下列说法正确的是

A. 1molC(g)与1molO2(g)的能量之和为393.5kJ
B. 反应2CO(g)+O2(g)=2CO2(g)中,反应物的总键能小于生成物的总键能
C. C→CO的热化学方程式为2C(s) +O2(g)=2CO(g) △H=-110.6kJ/mol
D. 热值是指一定条件下单位质量的物质完全燃烧所放出的热量,则CO的热值△H=10.1kJ/g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物燃料电池在净化废水(含有Cr2O![]() 离子)的同时能获得能源或得到有价值的化学产品,图为其工作原理。下列说法正确的是( )
离子)的同时能获得能源或得到有价值的化学产品,图为其工作原理。下列说法正确的是( )
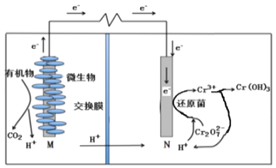
A.M为电源负极,有机物被还原
B.电池工作时,N极附近溶液pH减小
C.处理1molCr2O![]() 时有14molH+从交换膜左侧向右侧迁移
时有14molH+从交换膜左侧向右侧迁移
D.Cr2O![]() 离子浓度较大时,可能会造成还原菌失活
离子浓度较大时,可能会造成还原菌失活
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,利用培养皿探究NH3的性质。实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面。下表中对实验现象所做的解释正确的是( )

选项 | 实验现象 | 解释 |
A | 浓盐酸附近产生白烟 | NH3与浓盐酸反应产生了NH4Cl固体 |
B | 浓硫酸附近无明显现象 | NH3与浓硫酸不发生反应 |
C | 氯化物溶液变浑浊 | 该溶液一定是AlCl3溶液 |
D | 干燥红石蕊试纸不变色,湿润红石蕊试纸变蓝 | NH3是一种可溶性碱 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组设计实验,利用酸性KMnO4溶液与H2C2O4溶液反应,测定溶液紫色消失所需时间的方法,研究浓度对反应速率的影响。供选择的实验药品有:0.01mol·L-1酸性KMnO4溶液、0.1mol·L-1酸性KMnO4溶液、0.1mol·L-1H2C2O4溶液、0.2mol·L-1H2C2O4溶液。
(1)H2C2O4溶液与酸性KMnO4溶液反应的离子方程式为_______________。
(2)请完成以下实验设计表。
实验 | 酸性KMnO4溶液 | H2C2O4溶液 | 褪色时间/s | ||
c/(mol·L-1) | V/mL | c/(mol·L-1) | V/mL | ||
甲 | 0.01 | 4 | 0.1 | 2 | t1 |
乙 | a | 4 | b | 2 | t2 |
①表中a=________、b=________;
②甲组实验KMnO4的平均反应速率是:____________(用含t1的式子表示)。
(3)测得某次实验(恒温)时,溶液中Mn2+物质的量与时间关系如图。请解释n(Mn2+)在反应起始时变化不大、一段时间后快速增大的原因:___________________。
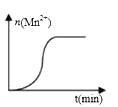
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以白云石(主要成分为CaCO3和MgCO3)为原料制备氧化镁和轻质碳酸钙的一种工艺流程如下:
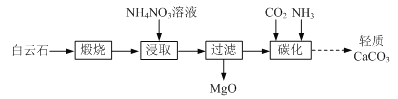
已知:Ksp[Mg(OH)2] = 5×1012
(1)白云石高温煅烧所得固体产物的主要成分为_______(填化学式)。
(2)NH4NO3溶液呈酸性的原因为_______(用离子方程式表示)。
(3)“浸取”后,c(Mg2+)应小于5×106 mol·L1,则需控制溶液pH ______。
(4)“碳化”反应的化学方程式为_______。
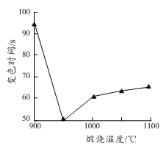
(5)煅烧所得固体的活性与其中CaO含量及固体疏松程度有关。其他条件相同时,将不同温度下的煅烧所得固体样品加入酸化的酚酞溶液中,引起溶液变色所需时间不同,由此可知煅烧所得固体的活性差异。溶液变色的时间与各样品煅烧温度的关系如图所示。当温度高于950 ℃时,煅烧所得固体易板结,活性降低;当温度低于950 ℃时,活性降低的原因为_______。将不同温度下的煅烧所得固体样品加入水中,也可测量其活性,则此时需测量的数据为相同时间后_______与样品煅烧温度之间的关系。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是合成降压药替米沙坦的重要中间体,其人工合成路线如下:
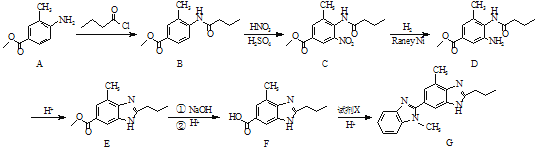
(1)C中含氧官能团的名称为酰胺键、_______和________。
(2)A→B的反应类型为______。
(3)试剂X的分子式为C7H10N2,写出X的结构简式:________。
(4)A的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:______。
①是α-氨基酸;
②苯环上有3种不同化学环境的氢原子。
(5)已知:①苯胺(![]() )有还原性,易被氧化;
)有还原性,易被氧化;
②硝基苯直接硝化产物为间二硝基苯
③![]()
![]() CH3COO-+CH3NH2
CH3COO-+CH3NH2
写出以![]() 和
和![]() 为原料制备
为原料制备![]() 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。______________________________
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把2.0 mol·L-1 CuSO4和1.0 mol·L1 H2SO4溶液等体积混合(假设混合后的溶液的体积等于混合前两种溶液的体积之和)计算:
(1)混合溶液中CuSO4和H2SO4的物质的量浓度c(CuSO4)=________;c(H2SO4)=________。
(2)混合液中H+和SO42-的物质的量浓度c(H+)=________;c(SO42-)=________。
(3)向溶液中加入铁粉,经过足够长的时间,铁粉有剩余。此时溶液中的物质的量浓度c(Fe2+)=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com