
【题目】以白云石(主要成分为CaCO3和MgCO3)为原料制备氧化镁和轻质碳酸钙的一种工艺流程如下:
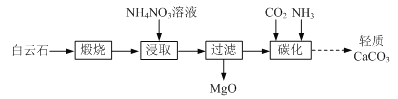
已知:Ksp[Mg(OH)2] = 5×1012
(1)白云石高温煅烧所得固体产物的主要成分为_______(填化学式)。
(2)NH4NO3溶液呈酸性的原因为_______(用离子方程式表示)。
(3)“浸取”后,c(Mg2+)应小于5×106 mol·L1,则需控制溶液pH ______。
(4)“碳化”反应的化学方程式为_______。
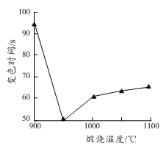
(5)煅烧所得固体的活性与其中CaO含量及固体疏松程度有关。其他条件相同时,将不同温度下的煅烧所得固体样品加入酸化的酚酞溶液中,引起溶液变色所需时间不同,由此可知煅烧所得固体的活性差异。溶液变色的时间与各样品煅烧温度的关系如图所示。当温度高于950 ℃时,煅烧所得固体易板结,活性降低;当温度低于950 ℃时,活性降低的原因为_______。将不同温度下的煅烧所得固体样品加入水中,也可测量其活性,则此时需测量的数据为相同时间后_______与样品煅烧温度之间的关系。
【答案】CaO、MgO NH![]() + H2O
+ H2O![]() NH3·H2O+H+ >11 Ca(NO3)2+ CO2 + 2NH3 = CaCO3↓+ 2NH4NO3 煅烧温度较低,CaCO3未完全分解,CaO的含量偏低 温度
NH3·H2O+H+ >11 Ca(NO3)2+ CO2 + 2NH3 = CaCO3↓+ 2NH4NO3 煅烧温度较低,CaCO3未完全分解,CaO的含量偏低 温度
【解析】
白云石(主要成分为CaCO3和MgCO3)高温煅烧得到CaO和MgO,由于铵根水解显酸性,所以之后加入硝酸铵调节pH浸取,使CaO溶解,浸取后溶液中的溶质主要为硝酸钙和一水合氨,过滤掉不溶的MgO,之后向溶液中依次通入过量氨气、二氧化碳,得到碳酸钙。
(1)高温煅烧白云石得到CaO和MgO;
(2)硝酸铵溶液中由于存在铵根的水解所以显碱性,水解方程式为NH![]() + H2O
+ H2O![]() NH3·H2O+H+;
NH3·H2O+H+;
(3)Ksp[Mg(OH)2] =c2(OHˉ)·c(Mg2+),当c(Mg2+)=5×106 mol·L1时,c(OHˉ)=![]() mol/L=1×10-3mol/L,此时pH=11,若c(Mg2+)小于5×106 mol·L1,则需要pH>11;
mol/L=1×10-3mol/L,此时pH=11,若c(Mg2+)小于5×106 mol·L1,则需要pH>11;
(4)硝酸铵浸取后溶液中的溶质主要为硝酸钙和一水合氨,通入氨气、二氧化碳,发生复分解反应,化学方程式为Ca(NO3)2+ CO2 + 2NH3 = CaCO3↓+ 2NH4NO3;
(5)煅烧温度较低,CaCO3未完全分解,CaO的含量偏低,所以活性降低;氧化钙和水反应放热,氧化钙含量越高与样品与水反应放出的热量越多,所以也可将不同温度下的煅烧所得固体样品加入水中,测量的相同时间后反应液的温度与样品煅烧温度之间的关系,来判断样品的活性。


科目:高中化学 来源: 题型:
【题目】某温度下,将3molA和2molB充入2L一密闭容器中,发生反应:A(g)+B(g)C(g)+D(g),5min后达到平衡。已知该温度下其平衡常数K=1,下列选项正确的是
A. C平衡浓度为1.2mol/L B. 速率v(B)= 0.08 mol/(Lmin)
C. A的转化率为40% D. B的转化率为40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铝合金(硬铝)中含有铝、镁、铜、硅,为了测定该合金中铝的含量,有人设计了如下实验:
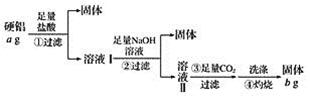
(1)溶液Ⅰ中的溶质为_________(填化学式,下同),溶液Ⅱ中的溶质为__________。
(2)上述第③步反应中,生成沉淀的离子方程式为____________。
(3)该合金中铝的含量为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全球气候变暖给人类的生存和发展带来了严峻的挑战,在此背景下,“新能源”、“低碳”、“节能减排”、“吃干榨尽”等概念愈来愈受到人们的重视。下列有关说法不正确的是
A. 太阳能、地热能、生物质能和核聚变能均属于“新能源”
B. “低碳”是指采用含碳量低的烃类作为燃料
C. 如图甲烷经一氯甲烷生成低碳烯烃的途径体现了“节能减排”思想

D. 让煤变成合成气,把煤“吃干榨尽”,实现了煤的清洁、高效利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据氨气还原氧化铜的反应,可设计测定铜元素相对原子质量Ar(Cu) (近似值)的实验。先称量反应物氧化铜的质量m(CuO),反应完全后测定生成物水的质量m(H2O),由此计算Ar(Cu)。为此,提供的实验仪器及试剂如下(根据需要可重复选用,加入的NH4C1与Ca(OH)2的量足以产生使CuO完全还原的氨气):
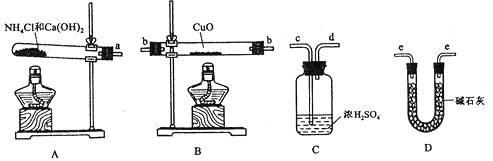
请回答下列问题:
(1)氨气还原炽热氧化铜的化学方程式为________________________________;
(2)从所提供的仪器及试剂中选择并组装本实验的一套合理、简单的装置,按气流方向的连接顺序为(用图中标注的导管口符号表示)a→______________________________;
(3)在本实验中,若测得m(CuO)=ag,m(H2O)=bg,则Ar(Cu)= _______________;
(4)在本实验中,使测定结果Ar(Cu)偏大的是_______________ (填序号);
①CuO未完全起反应 ② CuO不干燥
③CuO中混有不反应的杂质 ④碱石灰不干燥
⑤NH4C1与Ca(OH)2混合物不干燥
(5)在本实验中,还可通过测定_______________和_______________,或_______________和_______________达到实验目的。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下进行下列实验,根据实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 室温下,向苯酚钠溶液中通足量CO2,溶液变浑浊 | 碳酸的酸性比苯酚的强 |
B | 加热乙醇与浓硫酸的混合溶液,将产生的气体通入少量酸性KMnO4溶液,溶液紫红色褪去 | 有乙烯生成 |
C | 向5 mL 0.1 mol·L1 KI溶液中加入1 mL 0.1 mol·L1 FeCl3溶液,充分反应后,萃取分液,向水层中滴加KSCN溶液,溶液呈血红色 | I-与Fe3+的反应有一定限度 |
D | 向NaHCO3溶液中滴加紫色石蕊试液,溶液变蓝 | Kw<Ka1(H2CO3)×Ka2(H2CO3) |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中的一定量混合气体发生反应:![]() 平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.30mol/L。下列有关判断正确的是
平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.30mol/L。下列有关判断正确的是
A.x+y﹤zB.平衡向正反应方向移动
C.B的转化率降低D.C的体积分数升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸钴是一种重要的化工材料,广泛应用于有机合成。一种以铜钴矿(主要成分为Co2CuS4,一定量CuFeS2)为原料,生产草酸钴晶体(CoC2O4·2H2O)的工艺流程:
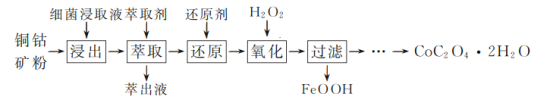
已知:①“浸出”液含有的离子主要有H+、Fe3+、Cu2+、Co3+、![]() ;
;
②pH增大,Fe2+被氧化的速率加快,同时生成的Fe3+水解形成更多的胶体;
③草酸钴晶体难溶于水;25℃时,Ksp[Co(OH)2]=1.6×10-15。
回答下列问题:
(1)生产时为提高铜钴矿粉浸出率,常采取的措施有________(填字母)。
a.适当延长浸出时间b.高温浸出c.分批加入细菌浸取液并搅拌
(2)“萃取”步骤中萃取除去的主要金属阳离子是________。
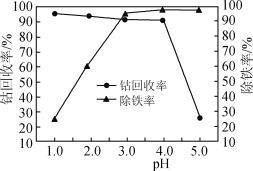
(3)“氧化”过程中,控制70℃、pH=4条件下进行,pH对除铁率和钴回收率的影响如图所示。
①用电子式表示H2O2的形成过程________。
②“氧化”过程的离子方程式为________。
③pH为4~5时,钴的回收率降低的原因是________。
(4)“过滤”后的滤液中加入(NH4)2C2O4溶液反应得到草酸钴晶体,过滤得到的草酸钴晶体需要用蒸馏水洗涤,检验晶体是否洗涤干净的方法是_______________。
(5)300℃时,在空气中煅烧CoC2O4·2H2O可制得Co3O4,该反应的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为阳离子交换膜法电解饱和食盐水原理示意图,下列说法不正确的是( )

A.从E口逸出的气体是H2
B.从D口加入含少量NaOH的水溶液以增强导电性
C.标准状况下每生成22.4 L Cl2,便产生2 mol NaOH
D.粗盐水中含Ca2+、Mg2+、Fe3+、SO42-等离子,精制时先加Na2CO3溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com