
����Ŀ�����ݰ�����ԭ����ͭ�ķ�Ӧ������ƲⶨͭԪ�����ԭ������Ar��Cu�� (����ֵ)��ʵ�顣�ȳ�����Ӧ������ͭ������m(CuO)����Ӧ��ȫ��ⶨ������ˮ������m(H2O)���ɴ˼���Ar��Cu����Ϊ�ˣ��ṩ��ʵ���������Լ�����(������Ҫ���ظ�ѡ�ã������NH4C1��Ca(OH)2�������Բ���ʹCuO��ȫ��ԭ�İ���)��
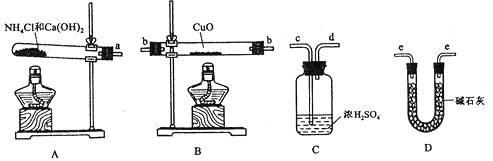
��ش��������⣺
(1)������ԭ��������ͭ�Ļ�ѧ����ʽΪ________________________________��
(2)�����ṩ���������Լ���ѡ����װ��ʵ���һ��������װ�ã����������������˳��Ϊ(��ͼ�б�ע�ĵ��ܿڷ��ű�ʾ)a��______________________________��
(3)�ڱ�ʵ���У������m(CuO)=ag��m(H2O)=bg����Ar��Cu��= _______________��
(4)�ڱ�ʵ���У�ʹ�ⶨ���Ar��Cu��ƫ�����_______________ (�����)��
��CuOδ��ȫ��Ӧ �� CuO������
��CuO�л��в���Ӧ������ �ܼ�ʯ�Ҳ�����
��NH4C1��Ca(OH)2����ﲻ����
(5)�ڱ�ʵ���У�����ͨ���ⶨ_______________��_______________����_______________��_______________�ﵽʵ��Ŀ�ġ�
���𰸡�2NH3+ 3CuO![]() 3Cu + 3H2O + N2 a�� e�� b�� e
3Cu + 3H2O + N2 a�� e�� b�� e ![]() -16 �٢� m(CuO) m(Cu) m(Cu) m(H2O)
-16 �٢� m(CuO) m(Cu) m(Cu) m(H2O)
��������
��1��������������ԭ�ԣ��ڼ��������¿��Ա�����ͭ������������Ϊ������ͭ��ˮ����Ӧ�Ļ�ѧ����ʽΪ2NH3+3CuO![]() 3Cu+3H2O+N2��
3Cu+3H2O+N2��
��2����Ϊ��Ҫ�ⶨ��Ӧ��������ˮ�����������Ա��豣֤ͨ��İ����Ǵ�������ģ�����Ũ��������백����Ӧ�����ֻ��ͨ����ʯ�ҽ��и����ͨ������ͭ���з�Ӧ�������ͨ���ʯ�����շ�Ӧ���ɵ�ˮ���Բ������ˮ��������������ȷ��˳��Ϊa��e��b��e��
��3�����ݷ�Ӧ����ʽ2NH3+3CuO![]() 3Cu+3H2O+N2��֪������ͭ��ˮ�����ʵ�����ȣ����������¹�ϵʽ��
3Cu+3H2O+N2��֪������ͭ��ˮ�����ʵ�����ȣ����������¹�ϵʽ��![]() =
=![]() �����Ar(Cu)=
�����Ar(Cu)=![]() ��16��
��16��
��4���ɣ�3����֪��Ar(Cu)=![]() ��16������CuOδ��ȫ��Ӧ��˵��bƫС�����ƫ����CuO�����˵��aƫС��bƫ���ƫ�ͣ�����CuO�л��в���Ӧ�����ʣ�˵��bƫС�����ƫ������ʯ�Ҳ����˵���������ﲻ���ף�bƫ���ƫ�ͣ�����NH4C1��Ca��OH��2����ﲻ�����ֻҪ�������ﳹ�ף��Խ����Ӱ�죻�ʴ�Ϊ�٢ۣ�
��16������CuOδ��ȫ��Ӧ��˵��bƫС�����ƫ����CuO�����˵��aƫС��bƫ���ƫ�ͣ�����CuO�л��в���Ӧ�����ʣ�˵��bƫС�����ƫ������ʯ�Ҳ����˵���������ﲻ���ף�bƫ���ƫ�ͣ�����NH4C1��Ca��OH��2����ﲻ�����ֻҪ�������ﳹ�ף��Խ����Ӱ�죻�ʴ�Ϊ�٢ۣ�
��5�����ݷ�Ӧ����ʽ2NH3+3CuO![]() 3Cu+3H2O+N2��֪��Ҳ����ͨ���ⶨm��CuO����m��Cu����m��Cu����m��H2O�����ﵽʵ��Ŀ�ģ��ʴ�Ϊm��CuO����m��Cu����m��Cu����m��H2O����
3Cu+3H2O+N2��֪��Ҳ����ͨ���ⶨm��CuO����m��Cu����m��Cu����m��H2O�����ﵽʵ��Ŀ�ģ��ʴ�Ϊm��CuO����m��Cu����m��Cu����m��H2O����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״���һ�ֿ�������Դ�����п�����Ӧ�õĹ���ǰ������ҵ��һ��ɲ������·������ϳɼ״���
��1����CO2�����״���
��֪��CO2��g��+3H2��g���TCH3OH��g��+H2O��l�� ��H=��akJmol��1��
2H2��g��+O2��g���T2H2O��l�� ��H=��b kJmol��1��
���ʾCH3OH��g��ȼ�յ��Ȼ�ѧ����ʽΪ��____________________��
��2����CO�����״���
��֪��CO(g)+2H2(g) ![]() CH3OH(g)����ͼ�Ǹ÷�Ӧ�ڲ�ͬ�¶���CO��ת������ʱ��仯�����ߡ�
CH3OH(g)����ͼ�Ǹ÷�Ӧ�ڲ�ͬ�¶���CO��ת������ʱ��仯�����ߡ�

�ٸ÷�Ӧ���ʱ䦤H__________0(�����������������)��
��T1��T2�¶��µ�ƽ�ⳣ����С��ϵ��K1_______K2 (�� ������������������)��
���������ݻ����䣬���д�ʩ�����Ӽ״����ʵ���______________��
A�������¶� B�� ��CH3OH(g)����ϵ�з���
C��ʹ�ú��ʵĴ��� D�� ����He��ʹ��ϵ��ѹǿ����
��3���״���CH3OH����������ȼ�ϵ�أ��õ���Dz��ò���̼������Ϊ�缫��������ϡ������Һ��ֱ�Ӽ��봿����ļ״���ͬʱ��һ���缫ͨ����������������ĵ缫��Ӧʽ��________________________�����������ĵ缫��Ӧʽ��_______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ߴ���������Ϊ�ϳ���������Ԫ�������ϵ�ԭ�ϣ���ҵ�Ͽ�����Ȼ�������̷������̿���Fe��Al��Mg��Zn��Ni��Si��Ԫ�أ��Ʊ�����������ͼ��ʾ���ش��������⣺
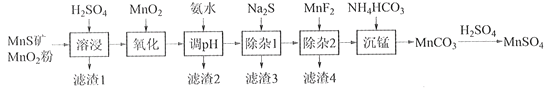
��ؽ�������[c0(Mn+)=0.1 mol��L1]�γ��������������pH��Χ���£�
�������� | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
��ʼ������pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
������ȫ��pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
��1��������1������S��__________________________��д�����ܽ����ж������������̷�Ӧ�Ļ�ѧ����ʽ____________________________________________________��
��2����������������������MnO2�������ǽ�________________________��
��3������pH��������������Һ��pH��ΧӦ����Ϊ_______~6֮�䡣
��4��������1����Ŀ���dz�ȥZn2+��Ni2+��������3������Ҫ�ɷ���______________��
��5��������2����Ŀ��������MgF2������ȥMg2+������Һ��ȹ��ߣ�Mg2+��������ȫ��ԭ����_____________________________________________________________________��
��6��д���������������ӷ���ʽ___________________________________________________��
��7����״��������Ԫ���Ͽ���Ϊ����ӵ���������ϣ��仯ѧʽΪLiNixCoyMnz2������Ni��Co��Mn�Ļ��ϼ۷ֱ�Ϊ+2��+3��+4����x=y=![]() ʱ��z=___________��
ʱ��z=___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ������������̽��NH3�����ʡ�ʵ��ʱ��NaOH�����ϵμ���Ũ��ˮ����������һ������������档�±��ж�ʵ�����������Ľ�����ȷ����(����)

ѡ�� | ʵ������ | ���� |
A | Ũ���ḽ���������� | NH3��Ũ���ᷴӦ������NH4Cl���� |
B | Ũ���ḽ������������ | NH3��Ũ���������Ӧ |
C | �Ȼ�����Һ����� | ����Һһ����AlCl3��Һ |
D | �����ʯ����ֽ����ɫ��ʪ���ʯ����ֽ���� | NH3��һ�ֿ����Լ� |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�������£�2g����C6H6����ȫȼ������Һ̬ˮ��CO2���ų�83.6kJ��������д��1molC6H6��ȫȼ�յ��Ȼ�ѧ����ʽ��______��
��2����֪��Fe2O3��s��+![]() C��s��=
C��s��=![]() CO2��g��+2Fe��s����H=+akJmol-1��C��s��+O2��g��=CO2��g����H=-bkJmol-1����2Fe��s��+
CO2��g��+2Fe��s����H=+akJmol-1��C��s��+O2��g��=CO2��g����H=-bkJmol-1����2Fe��s��+![]() O2��g��=Fe2O3��s���ġ�H=________��
O2��g��=Fe2O3��s���ġ�H=________��
��3����֪���ֻ�ѧ���ļ��������ʾ��
��ѧ�� | Cl��Cl | F��F | Cl��F |
����/ kJ��mol��1 | 242 | 159 | 172 |
��ӦCl2(g)+3F2(g)![]() 2ClF3(g)�ġ�H=_____________ kJ��mol-1��
2ClF3(g)�ġ�H=_____________ kJ��mol-1��
��4����ͼ�����顢������ȼ�չ����е������仯ͼ��
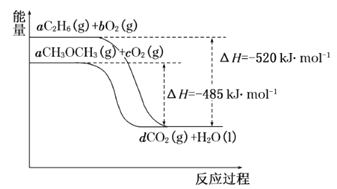
��ش��������⣺
�������ȼ������H=_______kJ��mol-1��
�ڸ�����ͼд����������ȫȼ��ʱ���Ȼ�ѧ����ʽ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʯ����Ҫ�ɷ�ΪCaCO3��MgCO3��Ϊԭ���Ʊ�����þ������̼��Ƶ�һ�ֹ����������£�
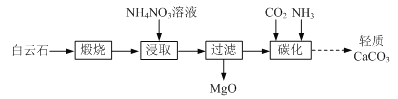
��֪��Ksp[Mg(OH)2] = 5��1012
��1������ʯ�����������ù���������Ҫ�ɷ�Ϊ_______���ѧʽ����
��2��NH4NO3��Һ�����Ե�ԭ��Ϊ_______�������ӷ���ʽ��ʾ����
��3������ȡ����c(Mg2+)ӦС��5��106 mol��L1�����������ҺpH ______��
��4����̼������Ӧ�Ļ�ѧ����ʽΪ_______��
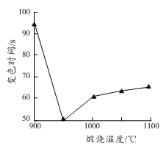
��5���������ù���Ļ���������CaO�������������ɳ̶��йء�����������ͬʱ������ͬ�¶��µ��������ù�����Ʒ�����ữ�ķ�̪��Һ�У�������Һ��ɫ����ʱ�䲻ͬ���ɴ˿�֪�������ù���Ļ��Բ��졣��Һ��ɫ��ʱ�������Ʒ�����¶ȵĹ�ϵ��ͼ��ʾ�����¶ȸ���950 ��ʱ���������ù����װ�ᣬ���Խ��ͣ����¶ȵ���950 ��ʱ�����Խ��͵�ԭ��Ϊ_______������ͬ�¶��µ��������ù�����Ʒ����ˮ�У�Ҳ�ɲ�������ԣ����ʱ�����������Ϊ��ͬʱ���_______����Ʒ�����¶�֮��Ĺ�ϵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��19.2 g Cu���뵽100 mLһ��Ũ�ȵ�������Һ�У��ٶ�����ǡ����ȫ��Ӧ��ͬʱ������״����8.96 L NO��NO2�Ļ������(����������ܽ⼰ת��)����
(1)���������NO��NO2������ȡ�_____________
(2)������Һ�����ʵ���Ũ�ȡ�__________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ȫʵ����һ�ֳ�������Ȼ���������ԭ���Ǵ���ѹǿ��Ը�����ͼ���ش��������⣺
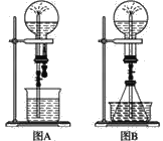
��1����ͼA����ƿ�г����������壬��ͷ�ιܼ��ձ��зֱ�ʢ��Һ�塣��������в������γ���Ȫ������________��
A���Ȼ����ˮ
B������������������Һ
C���Ȼ��������
D��������̼������������Һ
��2����ͼB����ƿ�У��ֱ�����������������ʣ���Ӧ����ܲ�����Ȫ������________��
A��ͭ��ϡ����
B��̼������������������Һ
C��̼�����ϡ����
D��̼�������ϡ����
��3����ͼB����ƿ���һˮ�ۣ���ƿ�м���ƾ���ˮ���м�����ˮ���ټ����������������ʣ����Ҳ��������Ȫ��ˮ���м�������ʲ���������________����
A��Ũ���� B����ʯ��
C������� D���ռ�
��4���Ƚ�ͼA��ͼB����װ�ã��Բ�����Ȫ��ԭ����������ͼA��__�ϲ���ƿ��ѹǿ�������г�����������Ȫ����ɽ������ԭ��������__(����ͼA������ͼB��)װ�õ�ԭ�����ơ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����Cl2ͨ������KOH��Һ�������п�����KCl��KClO��KClO3���Ҳ���ijɷ����¶ȸߵ��йأ���n��KOH��=amolʱ�������й�˵��������ǣ� ��
A. ij�¶��£���Ӧ��c��Cl������c��ClO����=6������Һ��c��ClO������c��ClO3����=1
B. �μӷ�Ӧ�����������ʵ�������0.5amol
C. �ı��¶ȣ���Ӧ��ת�Ƶ��ӵ����ʵ���n�ķ�Χ��![]() amol��n��
amol��n��![]() amol
amol
D. �ı��¶ȣ�������KClO3��������۲���Ϊ![]() amol
amol
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com