
【题目】甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下方法来合成甲醇:
(1)用CO2生产甲醇。
已知:CO2(g)+3H2(g)═CH3OH(g)+H2O(l) △H=﹣akJmol﹣1;
2H2(g)+O2(g)═2H2O(l) △H=﹣b kJmol﹣1;
则表示CH3OH(g)燃烧的热化学方程式为:____________________。
(2)用CO生产甲醇。
已知:CO(g)+2H2(g) ![]() CH3OH(g),下图是该反应在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g),下图是该反应在不同温度下CO的转化率随时间变化的曲线。

①该反应的焓变ΔH__________0(填“>”、“<”或“=”)。
②T1和T2温度下的平衡常数大小关系是K1_______K2 (填 “>”、“<”或“=”)。
③若容器容积不变,下列措施可增加甲醇产率的是______________。
A.升高温度 B. 将CH3OH(g)从体系中分离
C.使用合适的催化剂 D. 充入He,使体系总压强增大
(3)甲醇(CH3OH)可以用作燃料电池,该电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气。负极发生的电极反应式是________________________,正极发生的电极反应式是_______________________。
【答案】2CH3OH(g)+3O2(g) =2CO2 (g)+4H2O(l) ΔH = + (2a -3b) kJ·mol-1 < > B 2CH3OH -12e-+2H2O=2CO2+12H+ 3O2 + 12H+ + 12e- =6H2O
【解析】
(1)利用盖斯定律相加减,即可得出CH3OH燃烧的热化学方程式;
(2)①根据先拐先平法和温度对化学反应速率和化学平衡的影响来回答;
②温度对化学平衡常数的影响和反应的吸放热有关;
③化学平衡正向移动可增加甲醇产率;
(3)在甲醇燃料电池中,燃料甲醇作负极,发生失电子的氧化反应,氧气作正极,发生得电子的还原反应,即可得到正负极反应式。
(1)CO2(g)+3H2(g)═CH3OH(g)+H2O(l) △H=﹣akJmol﹣1 ①
2H2(g)+O2(g)═2H2O(l) △H=﹣b kJmol﹣1 ②
②×3-①×2得到2CH3OH(g)+3O2(g) =2CO2 (g)+4H2O(l) ΔH = + (2a -3b) kJ·mol-1 则表示CH3OH(g)燃烧的热化学方程式为:2CH3OH(g)+3O2(g) =2CO2 (g)+4H2O(l) ΔH = + (2a -3b) kJ·mol-1 ;
(2)①反应CO(g)+2H2(g)CH3OH(g)中,根据图像T2先出现拐点,T2反应速率快,则T2>T1,根据图像温度升高CO的平衡转化率减小,化学平衡向着逆反应方向移动,所以该反应是放热反应,ΔH<0,因此,本题正确答案是:<;
②对于放热反应,温度越高,化学平衡常数越小,T2>T1,反之越大,所以K1>K2,因此,本题正确答案是:>;
③A.若容器容积不变,升高温度,反应CO(g)+2H2(g)CH3OH(g)平衡逆向移动,甲醇产率低,故A项错误;B.将CH3OH从体系中分离,反应CO(g)+2H2(g)CH3OH(g)平衡正向移动,甲醇产率增大,故B正确;C.使用合适的催化剂不会引起化学平衡的移动,甲醇的转化率不变,故C错误;D.若容器容积不变,充入He,使体系总压强增大,各组分的浓度不变,化学平衡不移动,甲醇的转化率不变,故D错误;故选B;
(3)在甲醇燃料电池中,燃料甲醇作负极,发生失电子的氧化反应,氧气作正极,发生得电子的还原反应,负极发生的电极反应式是2CH3OH -12e-+2H2O=2CO2+12H+,正极发生的电极反应式是 3O2 + 12H+ + 12e- =6H2O


科目:高中化学 来源: 题型:
【题目】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下
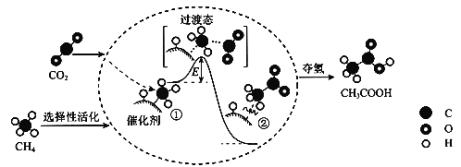
下列说法正确的是
A. 生成CH3COOH总反应的原子利用率小于100%
B. CH4+CO2→CH3COOH过程中,CH4分子中所有C―H键发生断裂
C. ①→②放出能量并形成了C―C键
D. 该催化剂可有效改变该反应的反应热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据物质的量相关计算填空:
(1)在标准状况下,1.6 g 某氧化物RO3体积为0.448L,则R的相对原子量为________。
(2)已知Wg气体A含有a个分子,那么在标准状况下,bg气体A所占的体积是________。(其中阿伏加德罗常数用NA表示)
(3)标准状况下,密度为0.75g/L的NH3与CH4组成的混合气体中,NH3的体积分数为________。
(4)VmLAl2(SO4)3溶液中含Al3+ ag,取V/5 mL溶液稀释到VmL,则稀释后溶液中的SO42-的物质的量浓度是______________ 。
(5)10 mL 0.1 mol·L-1 BaCl2溶液恰好能分别使相同体积的硫酸铁、硫酸铜两种溶液中的SO42-完全转化成沉淀,则硫酸铁、硫酸铜两种溶液的物质的量浓度之比是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对反应N2O4(g)![]() 2NO2(g);△H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
2NO2(g);△H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是

A. A、C两点的反应速率:A>C
B. A、C两点气体的颜色:A深,C浅
C. 由状态B到状态A,可以用加热的方法
D. B、C两点NO2的体积分数相同,所以平衡常数也相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3溶液中的水解反应:FeCl3+3H2O![]() Fe(OH)3+3HCl已达平衡,若要使FeCl3的水解程度增大,应采用的方法是
Fe(OH)3+3HCl已达平衡,若要使FeCl3的水解程度增大,应采用的方法是
A. 加入NaCl B. 加入AgNO3固体 C. 加入FeCl3固体 D. 加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国际计量大会第26次会议新修订了阿伏加德罗常数(NA=6.02214076×1023mol-1),并于2019年5月20日正式生效。下列说法正确的是
A. 56g聚乙烯分子中含碳碳双键的数目为2 NA
B. 2 mol NH3和3molO2在催化剂和加热条件下充分反应生成NO的分子数为2 NA
C. 铅蓄电池放电时负极净增质量比正极净增质量多16g时转移电子数为NA
D. 1L0.5mlol·L-1Al2Fe(SO4)4溶液中阳离子数目小于1.5 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)6.02×1023个氢氧根离子的物质的量是________mol,其摩尔质量为________。
(2)在标准状况下,0.01 mol某气体的质量为0.44 g,则该气体的密度为________g·L1(保留小数点后两位),该气体的相对分子质量为________。
(3)在标准状况下,由CO和CO2组成的混合气体为6.72 L,质量为12 g,此混合物中CO和CO2物质的量之比是________,CO的体积分数是________,CO的质量分数是________,C和O原子个数比是________,混合气体的平均相对分子质量是________,密度是________g·L1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com