
����Ŀ����ҵ����Ǧ����(��Ҫ�ɷ�ΪFeOCr2O3)��̼���ơ�����������Ϊԭ�������ظ����� (Na2Cr2O72H2O),����Ҫ��ӦΪ��
��4FeO Cr2O3 + 8Na2CO3 + 7O2 ![]() 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
��2Na2CrO4 + H2SO4 ![]() Na2SO4 + Na2Cr2O7 + H2O
Na2SO4 + Na2Cr2O7 + H2O
����˵������ȷ����
A.��Ӧ�ٺ͢ھ�Ϊ������ԭ��Ӧ
B.��Ӧ����FeO Cr2O3�ǻ�ԭ�����ڷ�Ӧ��ʧȥ���ӡ�
C.��Ӧ����Na2CrO4����������Ӧ
D.����l mol��CO2����Ӧ��ת��3.5 mol����
���𰸡�BD
��������
A���Ӧ���в�����Ԫ�صĻ��ϼ۱仯��������������ԭ��Ӧ����A����
B���Ӧ��1����OԪ�صĻ��ϼ۽��ͣ�Fe��CrԪ�صĻ��ϼ۾����ߣ�������������O2����ԭ����FeOCr2O3����B��ȷ��
C���Ӧ���в�����Ԫ�صĻ��ϼ۱仯��������������ԭ��Ӧ����C����
D���Ӧ��ֻ��OԪ�صĻ��ϼ۽��ͣ���0�۽���Ϊ-2�ۣ�����ת�Ƶ����ʵ���Ϊ�μӷ�Ӧ�����������ʵ�����4�����ɷ���ʽ��֪����l mol��CO2����Ӧ���������������ʵ���Ϊ![]() mol����ת�Ƶĵ��ӵ����ʵ���Ϊ
mol����ת�Ƶĵ��ӵ����ʵ���Ϊ![]() mol��4=33.5mol����D��ȷ��
mol��4=33.5mol����D��ȷ��
��ѡBD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ijЩ�����������ڸ����µ��û���Ӧ��Ϊ�����ȷ�Ӧ�������磺4Al+3MnO2![]() 2Al2O3+3Mn�������й�˵���������
2Al2O3+3Mn�������й�˵���������
A.�÷�ӦΪ�û���Ӧ
B.��Ӧ��������ΪMnO2����������ΪMn
C.�ӷ�Ӧ���ԱȽϻ�ԭ�ԣ�Alǿ��Mn
D.��Ӧ������1mol Al2O3ʱ��ת�Ƶĵ�����Ϊ6NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪij�ּ״�ȼ�ϵ��ʾ��ͼ������ʱ����������ͼ��ʾ�������ж���ȷ����
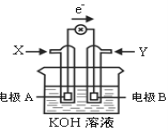
A��X����
B���缫A��Ӧʽ��CH3OH-6e-+H2O = CO2+6H+
C��B�缫������ҺpH����
D����ع���ʱ����Һ�е����ɵ缫B����缫A
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.4molX�����0.6molY��������2L�ܱ������У�ʹ���Ƿ������·�Ӧ��4X(g)+5Y(g) ![]() nZ(g)+6W(g)��2minĩ������0.3molW������֪��Z��Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊ0.05mol/(L��min)���Լ���
nZ(g)+6W(g)��2minĩ������0.3molW������֪��Z��Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊ0.05mol/(L��min)���Լ���
��1��ǰ2min����W��Ũ�ȱ仯��ʾ��ƽ����Ӧ����Ϊ_______________��
��2��2minĩʱY��Ũ��Ϊ_____________________________��
��3����ѧ��Ӧ����ʽ��n=_____________________________��
��4��2minĩ���ָ�����Ӧǰ�¶ȣ���ϵ��ѹǿ�Ƿ�Ӧǰѹǿ��__________����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������£���pH�������ͬ����������(HNO2��CH3COOH)�ֱ��ˮϡ�ͣ���pH���ˮ����ı仯����ͼ��ʾ��
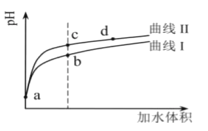
��֪���������£�HNO2��CH3COOH�ĵ��볣���ֱ�Ϊ5.0��10-4��1.7��10-5������˵����ȷ����
A.����II��������CH3COOH��Һ
B.��Һ��ˮ�ĵ���̶ȣ�b��>c��>d��
C.�����ͬ��a������Һ�ֱ���NaOH��Һǡ���к�ʱ��������Һ�У�n(![]() )��n(Na��)��n(CH3COO-)
)��n(Na��)��n(CH3COO-)
D.��c�㵽d�㣬��Һ��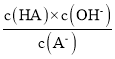 ���ֲ���(����HA��A-�ֱ������Ӧ������������)
���ֲ���(����HA��A-�ֱ������Ӧ������������)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ӧ2H2(g)+CO(g)![]() CH3OH(g)��ƽ�ⳣ�����±���������ͬ�����ʵ���Ͷ�ϣ�
CH3OH(g)��ƽ�ⳣ�����±���������ͬ�����ʵ���Ͷ�ϣ�
���CO�ڲ�ͬ�¶��µ�ƽ��ת������ѹǿ�Ĺ�ϵ����ͼ��ʾ�����д�С�Ƚ���ȷ����
ƽ�ⳣ�� | �¶�/�� | ||
500 | 700 | 800 | |
K | 2.50 | 0.34 | 0.15 |
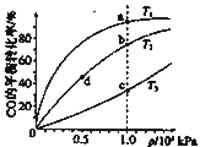
A.ƽ�᳣����K(a)��K(c)��K(b)=K(d)
B.����Ӧ���ʣ�v(a)��v(c)��v(b)=v(d)
C.�ﵽƽ������ʱ�䣺t(a)=t(c)��t(b)��t(d)
D.ƽ����Է���������M(a)=M(c)��M(b)��M(d)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ������������ء�����˵����ȷ���ǣ� ��
A.������������Ƭ�е�NaClO2����������
B.�����γɵķ�ĭ���ܽ����ڽ����ɢϵ
C.�������粼��ԭ�Ͼ۱�ϩ������Ȼ�л��߷���
D.�˹����еĹ���(��ͼ��ʾ)�����������ǽ�������
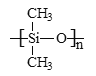
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijУѧ������ͼ��ʾװ�ý���ʵ�顣��̽�������巢����Ӧ��ԭ���������ᴿ��Ӧ�IJ��

��ش��������⣺
(1)д��װ�â��з�������Ҫ��ѧ��Ӧ����ʽ____________________________���������������������Ϊ������________���������θ���ܵ�������__________��
(2)ʵ�鿪ʼʱ���ر�K2������K1�ͷ�Һ©���������μӱ���Һ��Ļ��Һ����Ӧ��ʼ������С�Թ��ڱ���������_________________________��
(3)��˵������Һ�巢����ȡ����Ӧ��������______________________��
(4)��Ӧ������Ҫ��װ�â��е�ˮ������װ�â����Գ�ȥװ�â��в����HBr���塣�������ʵ����һ������______________________________________��
(5)�������屽����ɫ��״��Һ�壬���װ���Ƶõ��屽�ʺ���ɫ��ԭ�����������______________����������ƿ�ڷ�Ӧ���Һ�����ν�������ʵ������Ϳɵõ��ϴ������屽����������ˮϴ�ӣ�����Һ������__________ϴ�ӣ�����Һ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�����ú��������,�����Ȱ�úת��ΪCO��H2���ٽ�����ת��Ϊ�״���ijʵ����Ա��һ���¶���2L���ܱ������У�����һ������H2��CO��������Ӧ��2H2(g)+CO(g)![]() CH3OH(g)���ⶨ�IJ���ʵ���������£�
CH3OH(g)���ⶨ�IJ���ʵ���������£�
t/s | 0 | 500 | 1000 |
c(H2)/ mol.L-1 | 5.00 | 3.52 | 2.48 |
c(CO)/ mol.L-1 | 2.50 |
(1)��500s����H2��ʾ�Ļ�ѧ��Ӧ������________________��
(2)��1000s����CO��ʾ�Ļ�ѧ��Ӧ������________________��1000sʱCO��ת������________��
(3)��500sʱ���ɵļ״���Ũ����________
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com