
����Ŀ�������������£���pH�������ͬ����������(HNO2��CH3COOH)�ֱ��ˮϡ�ͣ���pH���ˮ����ı仯����ͼ��ʾ��
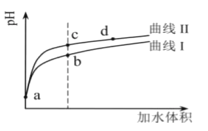
��֪���������£�HNO2��CH3COOH�ĵ��볣���ֱ�Ϊ5.0��10-4��1.7��10-5������˵����ȷ����
A.����II��������CH3COOH��Һ
B.��Һ��ˮ�ĵ���̶ȣ�b��>c��>d��
C.�����ͬ��a������Һ�ֱ���NaOH��Һǡ���к�ʱ��������Һ�У�n(![]() )��n(Na��)��n(CH3COO-)
)��n(Na��)��n(CH3COO-)
D.��c�㵽d�㣬��Һ��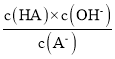 ���ֲ���(����HA��A-�ֱ������Ӧ������������)
���ֲ���(����HA��A-�ֱ������Ӧ������������)
���𰸡�D
��������
A����ĵ���ƽ�ⳣ��Խ���������Խǿ��pH��ͬ��HNO2��CH3COOH�ֱ��ˮϡ����ͬ�ı�����pHֵ�仯�ϴ����ǿ�ᣬ����ͼ֪������I��ʾCH3COOH������II��ʾHNO2����A����
B��������ˮ���룬����c(H+)Խ��������ˮ����̶�Խ������c(H+)��b��c��d����ˮ�ĵ���̶ȣ�b��c��d����B����
C����ͬ�����a��������Һ��n(��)��n(HNO2)��n(CH3COOH)���ֱ���NaOHǡ���кͺ�����n(NaOH)��HNO2��CH3COOH����Ӧ����Һ��n(NaNO2)��n(CH3COONa)����������Һ�У�n(![]() )��n(CH3COO-)��n(Na��)����C����
)��n(CH3COO-)��n(Na��)����C����
D���¶Ȳ���ˮ��ƽ�ⳣ�����䣬��c�㵽d���¶Ȳ��䣬��Һ��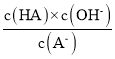 =Kh(HA)���䣬��D��ȷ��
=Kh(HA)���䣬��D��ȷ��
�ʴ�ΪD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������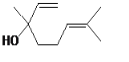 ���dz��õ����ϣ������йط�����˵����ȷ����
���dz��õ����ϣ������йط�����˵����ȷ����
A.��ʹ���Ը��������Һ����ˮ����ɫ��ԭ����ͬ
B.����������̼ԭ�ӹ�ƽ��
C.�����CCl4��Һ��Ӧ�������������
D.���л���![]() ��Ϊͬϵ��
��Ϊͬϵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ����ȷ����
A.������������ʽ���룺Al(OH)3+H2O[Al(OH)4]-+H+
B.����������ϡ���ᷴӦ��Fe+![]() +4H+===Fe3++NO��+2H2O
+4H+===Fe3++NO��+2H2O
C.��������Һ�м���Ba(OH)2��Һ��Al3+�պó�����ȫ��2Al3++3![]() +3Ba2++6OH-=2Al(OH)3��+3BaSO4��
+3Ba2++6OH-=2Al(OH)3��+3BaSO4��
D.̼����ˮ�⣺![]() +H2O
+H2O![]() +OH-
+OH-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ɽ����л�������û�����ͱ�֮��Ŀ��淴Ӧ��ʵ������ͼ��⣺C6H12(g)C6H6(g)��3H2(g)��һ�������£���ͼװ�ÿ�ʵ���л���ĵ绯ѧ����:
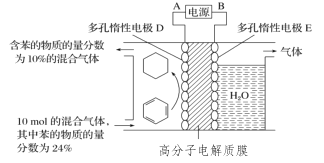
����˵������ȷ����
A.����Ե缫DΪ����
B.�Ӷ���Ե缫E����������������
C.�߷��ӵ����ĤΪ�����ӽ���Ĥ
D.����װ��������Ŀ�����ĵ缫��ӦʽΪC6H6+6H++6e-=C6H12
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС����0.80 mol/L��Ũ�ȵ��ռ���Һ�ⶨδ֪Ũ�ȵ����ᡣ
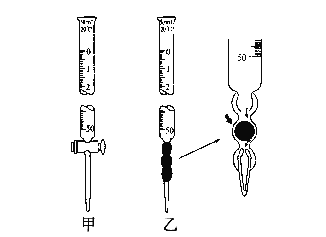
(1).�ζ�����ͼ��ʾ����______�ζ���ʢװ��Ũ�ȵ�����������Һ (����������������)��
(2).�õζ��ķ������ⶨ�����Ũ�ȣ�ʵ������������ʾ��
ʵ���� | ����HCl��Һ�����/mL | ����NaOH��Һ�����/mL |
1 | 20.00 | 23.00 |
2 | 20.00 | 23.10 |
3 | 20.00 | 22.90 |
��ʵ������ȥ��Һ�����Ϊ________ml��
(3).���в�����ʹ����õ������Ũ��ƫ�͵���________��
A��ʢװ����Һ����ƿ��ˮϴ��δ����
B���ζ�ǰ����ʽ�ζ��ܼ�������ݣ��ζ���������ʧ
C����ʽ�ζ���������ˮϴ����δ�ñ�����������Һ��ϴ
D������ʽ�ζ��ܵĿ̶�ʱ���ζ�ǰ���Ӱ�Һ����ʹ����ζ����Ӷ���
(4).�ζ������У��۾�Ӧע��________��������̨�ϵ�һ�Ű�ֽ����Ŀ����_______________��
���÷�̪��ָʾ�������жϴﵽ�ζ��յ�ʱ��������__________________��
(5).�����ϱ����ݣ����㱻����������ʵ���Ũ����________mol/L��(С���������λ��Ч����)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ����Ǧ����(��Ҫ�ɷ�ΪFeOCr2O3)��̼���ơ�����������Ϊԭ�������ظ����� (Na2Cr2O72H2O),����Ҫ��ӦΪ��
��4FeO Cr2O3 + 8Na2CO3 + 7O2 ![]() 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
��2Na2CrO4 + H2SO4 ![]() Na2SO4 + Na2Cr2O7 + H2O
Na2SO4 + Na2Cr2O7 + H2O
����˵������ȷ����
A.��Ӧ�ٺ͢ھ�Ϊ������ԭ��Ӧ
B.��Ӧ����FeO Cr2O3�ǻ�ԭ�����ڷ�Ӧ��ʧȥ���ӡ�
C.��Ӧ����Na2CrO4����������Ӧ
D.����l mol��CO2����Ӧ��ת��3.5 mol����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܵ������ˮ�д��ڳ����ܽ�ƽ�⣬��AgClAg++Cl-������ƽ���д����������̣�һ��������ˮ���ӵ������£���Һ��������Ag+��Cl-����AgCl�������ˮ��(�ܽ����)����һ���棬��Һ�е�Ag+��Cl-��AgCl�������������ӵ��������ص�AgCl��������(��������)�����ܽ����ʺͳ����������ʱ���γ�AgCl������Һ���ﵽ�����ܽ�ƽ�⡣���ܶȻ�������ʾ��Ksp=c(Ag+)c(Cl-)������Һ�е�c(Ag+)c(Cl-)>Ksp(AgCl)ʱ�����г���������
��֪���������£�Ksp(AgBr)=5.4��10-13��Ksp(AgCl)=1.8��10-10��
��BaCl2��Һ�м���AgNO3��KBr�������ֳ����պù���ʱ����Һ��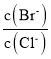 =____��д����Ҫ������̣�_________��
=____��д����Ҫ������̣�_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڸ��������£�����ѡ����ʾ�����ʼ�ת������ʵ�ֵ��ǣ� ��
A.NaCl(aq)![]() Cl2(aq)
Cl2(aq)![]() FeCl2(s)
FeCl2(s)
B.CuO(s)![]() Cu(OH)2(s)
Cu(OH)2(s)![]() Cu2O(s)
Cu2O(s)
C.NH3(g)![]() NO(g)
NO(g)![]() HNO3(aq)
HNO3(aq)
D.HClO(aq)![]() Cl2(g)
Cl2(g)![]() SiCl4(g)
SiCl4(g)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ơ���������������Ҫ�Ľ�������ش�
(1)�뻭���Ƶ�ԭ�ӽṹʾ��ͼ_______ �������Ƶ�ԭ�ӽṹʾ��ͼ�ɵó��Ƶ���Щ���ʣ�(д��һ��)_________��
(2)�����ֽ����Ľ��������ǿ������˳����_________ ��
(3)С�������Ͷ��ˮ�У�������Ӧ�Ļ�ѧ����ʽΪ_______________���ɹ۲쵽��ʵ��������_________ (����ĸ)��
a.�Ƴ���ˮ�� b.���۳�С�� c.С���Ĵ��ζ�d.ˮ���ɫ
(4)����ϡ���ᷴӦ�����ӷ���ʽΪ_________________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com