
【题目】难溶电解质在水中存在沉淀溶解平衡,如AgClAg++Cl-,上述平衡中存在两个过程:一方面是在水分子的作用下,溶液中少量的Ag+和Cl-脱离AgCl表面进入水中(溶解过程);另一方面,溶液中的Ag+和Cl-受AgCl表面阴、阳离子的吸引,回到AgCl表面析出(沉淀过程)。当溶解速率和沉淀速率相等时,形成AgCl饱和溶液,达到沉淀溶解平衡。用溶度积常数表示:Ksp=c(Ag+)c(Cl-)。当溶液中的c(Ag+)c(Cl-)>Ksp(AgCl)时,即有沉淀析出。
已知:在室温下,Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=1.8×10-10。
向BaCl2溶液中加入AgNO3和KBr,当两种沉淀刚好共存时,溶液中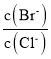 =____,写出简要计算过程:_________。
=____,写出简要计算过程:_________。
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案科目:高中化学 来源: 题型:
【题目】探索CO和NO2这类化合物的特征及反应机理,对处理该类化合物的污染问题具有重要意义。回答下列问题:
I.CO可以与H2反应制备合成天然气(SNG)。涉及反应如下:
CO甲烷化:CO(g)+3H2(g)CH4(g)+H2O(g)![]() 1=-206.2kJ·mol-1
1=-206.2kJ·mol-1
水煤气变换:CO(g)+H2O(g)CO2(g)+H2(g)![]() 2=-41.2kJ·mol-1
2=-41.2kJ·mol-1
(1)反应CO2(g)+4H2(g) CH4(g)+2H2O(g)的![]() =_____kJ·mol-1。某温度下,分别在起始体积相同的恒容容器A、恒压容器B中加入1molCO2和4molH2的混合气体,两容器反应达平衡后放出或吸收的热量较多的是_____(填“A”或“B”)。
=_____kJ·mol-1。某温度下,分别在起始体积相同的恒容容器A、恒压容器B中加入1molCO2和4molH2的混合气体,两容器反应达平衡后放出或吸收的热量较多的是_____(填“A”或“B”)。
(2)在恒压管道反应器中将原料气H2和CO按一定比例通入,在催化剂作用下制备合成天然气,400℃、p总为100kPa时反应体系平衡组成如表所示。
组分 | CH4 | H2O | H2 | CO2 | CO |
体积分数 | 45.0 | 42.5 | 10.0 | 2.00 | 0.500 |
该条件下CO的总转化率α=______。若将管道反应器升温至500℃,反应达到平衡后CH4的体积分数![]() ______45.0%(填“>”、“<”或“=”)。
______45.0%(填“>”、“<”或“=”)。
II.NO2可发生二聚反应生成N2O4,化学方程式为2NO2![]() N2O4。该反应达到平衡后,升高温度可使体系颜色加深。
N2O4。该反应达到平衡后,升高温度可使体系颜色加深。
(3)已知该反应的正反应速率方程为υ正=k正·c2(NO2),逆反应速率方程为υ逆=k逆·c(N2O4),其中k正、k逆分别为正、逆反应的速率常数。则右图(lgk表示速率常数的对数;![]() 表示温度的倒数)所示①、②、③、④四条斜线中,能表示lgk正随
表示温度的倒数)所示①、②、③、④四条斜线中,能表示lgk正随![]() 变化关系的是斜线______,能表示lgk逆随
变化关系的是斜线______,能表示lgk逆随![]() 变化关系的是斜线______。
变化关系的是斜线______。
(4)图中A、B、C、D点的纵坐标分别为a+1.5、a+0.5、a-0.5、a-1.5,则T1温度时化学平衡常数K=______mol-1·L。已知T1温度时,某时刻恒容密闭容器中NO2、N2O4浓度均为0.2mol·L-1,此时υ正______υ逆(填>或<);该反应达到平衡后,若将温度从T1升高到T2重新达到平衡,则T1温度时平衡压强p(T1)______T2温度时平衡压强p(T2)(填“>”、“=”或“<”),原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
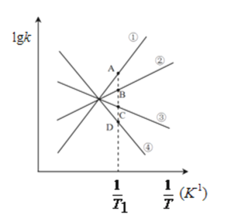
【题目】测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。
(1)写出该反应的热化学方程式(中和热为57.3 kJ·mol-1):_____。
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如表。
①请填写表中的空白:
温度 实验次数 | 起始温度T1/℃ | 终止温度 T2/℃ | 温度差平 均值(T2 -T1)/℃ | ||
H2SO4 溶液 | NaOH 溶液 | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | ___ |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50mol·L-1NaOH溶液和0.50mol·L-1硫酸溶液的密度都是1g·cm-3,中和后生成溶液的比热容c=4.18J·g-1·℃-1。则中和热ΔH=____(取小数点后一位)。
③上述实验数值结果与57.3kJ·mol-1有偏差,产生偏差的原因可能是____(填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】保持在室温下,将pH和体积相同的这两种酸(HNO2和CH3COOH)分别加水稀释,其pH随加水体积的变化如下图所示。
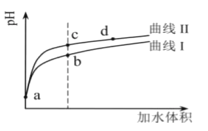
已知:在室温下,HNO2和CH3COOH的电离常数分别为5.0×10-4和1.7×10-5,下列说法正确的是
A.曲线II代表的是CH3COOH溶液
B.溶液中水的电离程度:b点>c点>d点
C.体积相同的a点两溶液分别与NaOH溶液恰好中和时,两份溶液中:n(![]() )=n(Na+)=n(CH3COO-)
)=n(Na+)=n(CH3COO-)
D.从c点到d点,溶液中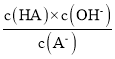 保持不变(其中HA、A-分别代表相应的酸和酸根离子)
保持不变(其中HA、A-分别代表相应的酸和酸根离子)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氟化氮(NF3)是一种无色、无臭的气体。三氟化氮在一定条件下与水蒸气能发生氧化还原反应,反应产物中生成酸 X、酸 Y 和一种无色气体(遇空气变成红棕色),其中酸 X 是一种弱酸,酸Y 为常见的含氧强酸。
(1)NF3的空间构型为__________。
(2)酸X是弱酸(难电离)的可能原因是______。
(3)工业上通过 NH3 和氟气(F2)反应制备 NF3,请结合题给信息,判断NF3主要表现出来的化学性质是_______。
(4)NF3的一种下游产品三聚氟氰(分子式为:C3N3F3),分子结构中显示有环状结构,请从价键理论和物质的相对稳定性角度写出三聚氟氰的结构式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列说法正确的是( )
A.二氧化氯泡腾片中的NaClO2属于氧化物
B.咳嗽形成的飞沫气溶胶属于胶体分散系
C.口罩熔喷布的原料聚丙烯属于天然有机高分子
D.人工肺中的硅橡胶(如图所示)属于新型无机非金属材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列各组物质中,找出合适的序号填在对应的空格内:
①NO2和N2O4 ②12C和14C ③40 19K和40 20Ca
④异戊烷( )
)
和新戊烷( )
)
⑤ 和
和 ⑥甲烷和丙烷
⑥甲烷和丙烷
(1)互为同位素的是________。
(2)互为同分异构体的是________。
(3)互为同系物的是________。
(4)为同一种物质的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用纯净的CaCO3与稀HCl反应制CO2,实验过程记录如右图所示。根据分析、判断,正确的是( )
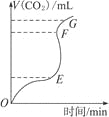
A.OE段表示的反应速率最快
B.EF段表示的反应速率最快,收集的CO2最多
C.FG段收集的CO2最多
D.OG段表示随着时间的推移,反应速率逐渐增快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在起始压强为80kPa的刚性容器中,发生NO的氧化反应:2NO(g)+O2(g)2NO2(g) △H,该反应的反应历程分两步进行,其速率方程和反应过程中能量变化如下:
①2NO(g)N2O2(g) v1正=k1正c2(NO) v1逆=k1逆c(N2O2)
②N2O2(g)+O2(g)2NO2(g) v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2)
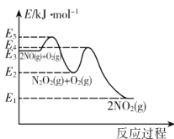
下列说法正确的是
A.NO氧化反应速率快慢的决定步骤的活化能是E5—E3
B.一定温度下,2NO(g)+O2(g)2NO2 (g)平衡常数表达式K=![]()
C.升高温度,NO氧化反应的化学平衡向逆反应方向移动
D.该温度下,将等物质的量的NO和O2混合反应(忽略2NO2N2O4),NO的平衡转化率为40%时,该反应的平衡常数Kp=![]() kPa-1
kPa-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com