
【题目】探索CO和NO2这类化合物的特征及反应机理,对处理该类化合物的污染问题具有重要意义。回答下列问题:
I.CO可以与H2反应制备合成天然气(SNG)。涉及反应如下:
CO甲烷化:CO(g)+3H2(g)CH4(g)+H2O(g)![]() 1=-206.2kJ·mol-1
1=-206.2kJ·mol-1
水煤气变换:CO(g)+H2O(g)CO2(g)+H2(g)![]() 2=-41.2kJ·mol-1
2=-41.2kJ·mol-1
(1)反应CO2(g)+4H2(g) CH4(g)+2H2O(g)的![]() =_____kJ·mol-1。某温度下,分别在起始体积相同的恒容容器A、恒压容器B中加入1molCO2和4molH2的混合气体,两容器反应达平衡后放出或吸收的热量较多的是_____(填“A”或“B”)。
=_____kJ·mol-1。某温度下,分别在起始体积相同的恒容容器A、恒压容器B中加入1molCO2和4molH2的混合气体,两容器反应达平衡后放出或吸收的热量较多的是_____(填“A”或“B”)。
(2)在恒压管道反应器中将原料气H2和CO按一定比例通入,在催化剂作用下制备合成天然气,400℃、p总为100kPa时反应体系平衡组成如表所示。
组分 | CH4 | H2O | H2 | CO2 | CO |
体积分数 | 45.0 | 42.5 | 10.0 | 2.00 | 0.500 |
该条件下CO的总转化率α=______。若将管道反应器升温至500℃,反应达到平衡后CH4的体积分数![]() ______45.0%(填“>”、“<”或“=”)。
______45.0%(填“>”、“<”或“=”)。
II.NO2可发生二聚反应生成N2O4,化学方程式为2NO2![]() N2O4。该反应达到平衡后,升高温度可使体系颜色加深。
N2O4。该反应达到平衡后,升高温度可使体系颜色加深。
(3)已知该反应的正反应速率方程为υ正=k正·c2(NO2),逆反应速率方程为υ逆=k逆·c(N2O4),其中k正、k逆分别为正、逆反应的速率常数。则右图(lgk表示速率常数的对数;![]() 表示温度的倒数)所示①、②、③、④四条斜线中,能表示lgk正随
表示温度的倒数)所示①、②、③、④四条斜线中,能表示lgk正随![]() 变化关系的是斜线______,能表示lgk逆随
变化关系的是斜线______,能表示lgk逆随![]() 变化关系的是斜线______。
变化关系的是斜线______。
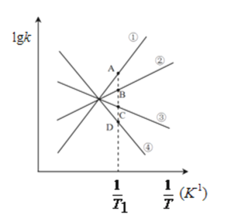
(4)图中A、B、C、D点的纵坐标分别为a+1.5、a+0.5、a-0.5、a-1.5,则T1温度时化学平衡常数K=______mol-1·L。已知T1温度时,某时刻恒容密闭容器中NO2、N2O4浓度均为0.2mol·L-1,此时υ正______υ逆(填>或<);该反应达到平衡后,若将温度从T1升高到T2重新达到平衡,则T1温度时平衡压强p(T1)______T2温度时平衡压强p(T2)(填“>”、“=”或“<”),原因是______。
【答案】-165 B 98.9%或![]() < ③ ④ 10 > < 温度升高体积不变,总压强增大;温度升高平衡左移,体系总物质的量增加,总压强增大
< ③ ④ 10 > < 温度升高体积不变,总压强增大;温度升高平衡左移,体系总物质的量增加,总压强增大
【解析】
I (1)①CO(g)+3H2(g)CH4(g)+H2O(g)△H1=-206.2kJmol-1
②CO(g)+H2O(g)CO2(g)+H2(g)△H2=-41.2kJmol-1
将方程式①-②得CO2(g)+4H2(g)CH4(g)+2H2O(g),计算△H;
A为恒温恒容、B为恒温恒压条件,如果是恒温恒容,反应前后物质的量减小、压强减小,开始时AB压强相等,A中压强逐渐减小B中压强不变,所以反应过程中压强A<B,增大压强平衡正向移动;
(2)根据CO甲烷化:CO(g)+3H2(g)CH4(g)+H2O(g)反应,设n(H2)=3mol、n(CO)=1mol,恒容恒温条件下气体的体积分数之比等于物质的量分数之比,设平衡时混合气体总物质的量为xmol,根据C原子守恒得(45.0%+2.00%+0.5%)×xmol=1mol,x=![]() ,则CO的转化率=
,则CO的转化率=![]() ×100%;该反应的正反应是放热反应,升高温度平衡逆向移动;
×100%;该反应的正反应是放热反应,升高温度平衡逆向移动;
II(3)化学反应速率与温度成正比,随着温度的降低,![]() 增大,正逆反应速率降低,则lgk正和lgk逆均减小,由于温度降低平衡正向移动,则v正>v逆,则降低相同的温度时lgk逆减小更快,据此分析;
增大,正逆反应速率降低,则lgk正和lgk逆均减小,由于温度降低平衡正向移动,则v正>v逆,则降低相同的温度时lgk逆减小更快,据此分析;
(4)化学平衡常数K=![]() ,平衡时v正=v逆,再利用C点和D点的数据求得k正和k逆;比较浓度熵Qc与K值的大小,若Qc>K则平衡正向移动,若Qc=K则达到平衡,若Qc<K则平衡正向移动;升高温度体系颜色加深,平衡逆向移动,则正反应放热,上述反应达到平衡后,恒容体系,体积不变,升高温度,平衡逆向移动,气体物质的量增大,据此分析。
,平衡时v正=v逆,再利用C点和D点的数据求得k正和k逆;比较浓度熵Qc与K值的大小,若Qc>K则平衡正向移动,若Qc=K则达到平衡,若Qc<K则平衡正向移动;升高温度体系颜色加深,平衡逆向移动,则正反应放热,上述反应达到平衡后,恒容体系,体积不变,升高温度,平衡逆向移动,气体物质的量增大,据此分析。
I (1)①CO(g)+3H2(g)CH4(g)+H2O(g)△H1=-206.2kJmol-1
②CO(g)+H2O(g)CO2(g)+H2(g)△H2=-41.2kJmol-1
根据盖斯定律,将方程式①-②得CO2(g)+4H2(g)CH4(g)+2H2O(g),△H=(-206.2+41.2)kJ/mol=-165kJ/mol;A为恒温恒容、B为恒温恒压条件,如果是恒温恒容,反应前后物质的量减小、压强减小,开始时AB压强相等,A中压强逐渐减小B中压强不变,所以反应过程中压强A<B,增大压强平衡正向移动,则B放出的热量多;
(2)根据CO甲烷化:CO(g)+3H2(g)CH4(g)+H2O(g)反应,设n(H2)=3mol、n(CO)=1mol,恒容恒温条件下气体的体积分数之比等于物质的量分数之比,设平衡时混合气体总物质的量为xmol,根据C原子守恒得(45.0%+2.00%+0.5%)xmol=1mol,x=![]() ,则CO的转化率=
,则CO的转化率=![]() ×100%=
×100%=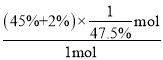 ×100%=
×100%= ![]() ×100%或98.9%;该反应的正反应是放热反应,升高温度平衡逆向移动,则反应迅达到平衡后CH4的体积分数减小,即φ<45%;
×100%或98.9%;该反应的正反应是放热反应,升高温度平衡逆向移动,则反应迅达到平衡后CH4的体积分数减小,即φ<45%;
II(3)化学反应速率与温度成正比,随着温度的降低,![]() 增大,正逆反应速率降低,则lgk正和lgk逆均减小,由于温度降低平衡正向移动,则v正>v逆,则降低相同的温度时lgk逆减小更快,则斜线③表示lgk正随
增大,正逆反应速率降低,则lgk正和lgk逆均减小,由于温度降低平衡正向移动,则v正>v逆,则降低相同的温度时lgk逆减小更快,则斜线③表示lgk正随![]() 变化关系,斜线④能表示lgk逆随
变化关系,斜线④能表示lgk逆随![]() 变化关系;
变化关系;
(4)化学平衡常数K=![]() =
=![]() =10;已知T1温度时,某时刻恒容密闭容器中NO2、N2O4浓度均为0.2mol·L-1,Qc=
=10;已知T1温度时,某时刻恒容密闭容器中NO2、N2O4浓度均为0.2mol·L-1,Qc=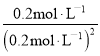 =5<K,则平衡正向移动,v正>v逆;升高温度体系颜色加深,平衡逆向移动,则正反应放热,上述反应达到平衡后,恒容体系,体积不变,升高温度,平衡逆向移动,气体物质的量增大,体系总压强增大,则T1温度时平衡压强p(T1)<T2温度时平衡压强p(T2)。
=5<K,则平衡正向移动,v正>v逆;升高温度体系颜色加深,平衡逆向移动,则正反应放热,上述反应达到平衡后,恒容体系,体积不变,升高温度,平衡逆向移动,气体物质的量增大,体系总压强增大,则T1温度时平衡压强p(T1)<T2温度时平衡压强p(T2)。


科目:高中化学 来源: 题型:
【题目】粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验:
①取适量A进行铝热反应,产物中有单质B生成;
②另取20 g A全部溶于0.15 L 6.0 mol·L-1盐酸中,得溶液C;
③将①中得到的单质B和溶液C反应,放出1.12 L(标况)气体,同时生成溶液D,还残留有固体物质B;
④用KSCN溶液检验时,溶液D不变色。
请填空:
(1)①中引发铝热反应的实验操作是___________,产物中的单质B是________。
(2)②中所发生的各反应的化学方程式是___________。
(3)③中所发生的各反应的离子方程式是___________。
(4)若溶液D的体积仍视为0.15 L,则该溶液中c(Mg2+)为________,c(Fe2+)为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有效脱除烟气中的SO2是环境保护的重要课题。
(1)氨水可以脱除烟气中的SO2。氨水脱硫的相关热化学方程式如下:
2NH3(g) +H2O(l) +SO2(g) =(NH4)2SO3(aq) ΔH= akJ·mol1
(NH4)2SO3(aq)+H2O(l) +SO2(g) =2NH4HSO3(aq) ΔH = bkJ·mol1
2(NH4)2SO3(aq) +O2(g) =2(NH4)2SO4(aq) ΔH =ckJ·mol1
反应NH3(g) +NH4HSO3(aq) +![]() O2(g) = (NH4)2SO4(aq)的ΔH=____kJ·mol1。
O2(g) = (NH4)2SO4(aq)的ΔH=____kJ·mol1。
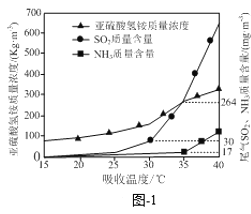
已知:SO2的国家排放标准为80mg·m3。氨水脱除烟气中的SO2是在吸收塔中进行的,控制其他实验条件相同,仅改变吸收塔的温度,实验结果如题图-1所示,为了尽可能获得NH4HSO3,则吸收塔合适的温度约为________。
A.25℃ B.31℃ C.35℃
(2)电解法可以脱除烟气中的SO2。用Na2SO4溶液吸收烟气中的SO2,使用惰性电极电解吸收后的溶液,H2SO3在阴极被还原为硫单质,阴极的电极反应式为_______。
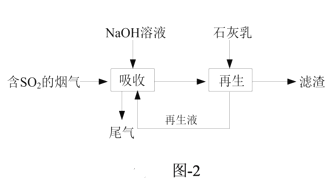
(3)钠钙双碱法可高效脱除烟气中的SO2,脱硫的流程如题图-2所示。
①“吸收”时气液逆流在吸收塔中接触,吸收时不宜直接使用石灰乳的原因是_______。

②水溶液中H2SO3、HSO![]() 、SO
、SO![]() 随pH的分布如题图3所示,“再生液”用NaOH溶液调pH至7~9得到溶液X,溶液X吸收SO2时主要反应的离子方程式为______。
随pH的分布如题图3所示,“再生液”用NaOH溶液调pH至7~9得到溶液X,溶液X吸收SO2时主要反应的离子方程式为______。
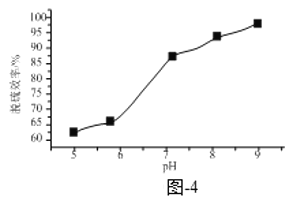
③已知Na2SO3的溶解度随着pH增大而减小。溶液X的pH对脱硫效率的影响如题图-4所示。当pH由6升高到7时,脱硫效率迅速增大的原因为______;当pH大于7时,随pH增大脱硫效率增速放缓的原因为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳樟醇(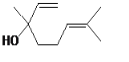 )是常用的香料,下列有关芳樟醇说法正确的是
)是常用的香料,下列有关芳樟醇说法正确的是
A.能使酸性高锰酸钾溶液和溴水均褪色的原理不同
B.分子中所有碳原子共平面
C.与溴的CCl4溶液反应,产物仅有两种
D.与有机物![]() 互为同系物
互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y和Z为原子序数依次增大的四种短周期主族元素。X在短周期元素中原子半径最大,Y的最高正价与最低负价代数和为0,Z是所在周期非金属性最强的元素,W、X、Y三种元素形成的一种化合物结构如右图所示。下列叙述不正确的是
![]()
A.W和X形成的化合物的水溶液呈碱性
B.气态氢化物稳定性:Z>Y
C.右图化合物中W和Y均满足8电子稳定结构
D.可用pH试纸测定Z单质水溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子液体由于其具有良好的化学稳定性,较低的熔点和良好的溶解性,应用越来越广泛。如图为某离子液体的结构,回答下列问题:
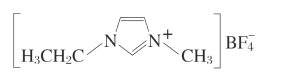
(1)基态N原子的价电子排布图为______。![]() 中,B原子杂化方式为______,与
中,B原子杂化方式为______,与![]() 互为等电子体的含氧酸根离子是______(写出一种即可);在周期表中,与B的化学性质最相似的邻族元素是_____,它们性质相似的原因是_____。
互为等电子体的含氧酸根离子是______(写出一种即可);在周期表中,与B的化学性质最相似的邻族元素是_____,它们性质相似的原因是_____。
(2)NH3极易溶于水的原因与氢键有关,用“…”表示氢键,结合NH3·H2O的电离推测NH3·H2O可能结构式为_____。
(3)离子液体是在室温和室温附近温度下呈液态的盐类物质。该离子液体常温下为液体,而NaBF4常温下为固体,其原因是_____。
(4)分子中的大![]() 键可用符号
键可用符号![]() 表示,其中m代表参与形成大
表示,其中m代表参与形成大![]() 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大![]() 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大![]() 键可表示为
键可表示为![]() ),则该离子液体的阳离子中存在的一个大
),则该离子液体的阳离子中存在的一个大![]() 键可表示为_____。
键可表示为_____。
(5)某硼的含氧酸根离子为无限链状结构,节选部分结构如图1所示,其离子的化学式可用通式表示为_____(用n代表B原子数)。
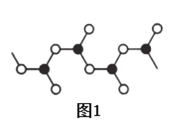
(6)某种含B和N两种元素的功能陶瓷,其晶胞结构如图2所示。已知该晶胞底面为菱形,其底边长为acm,高为bcm,晶体密度为_____g·cm-3(列出含有a,b,NA的计算式即可)。
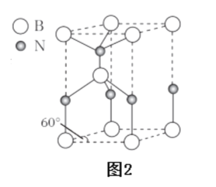
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的制备与工业生产相符的是
①NH3![]() NO
NO![]() HNO3
HNO3
②浓HCl![]() Cl2
Cl2 ![]() 漂白粉
漂白粉
③MgCl2(aq)![]() 无水MgCl2
无水MgCl2![]() Mg
Mg
④饱和NaCl(aq)![]() NaHCO3
NaHCO3![]() Na2CO3
Na2CO3
⑤铝土矿![]() NaAlO2溶液
NaAlO2溶液![]() Al(OH)3
Al(OH)3![]() Al2O3
Al2O3![]() Al
Al
A. ①④⑤ B. ①③⑤ C. ②③④ D. ②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式不正确的是
A.氢氧化铝的酸式电离:Al(OH)3+H2O[Al(OH)4]-+H+
B.过量铁粉与稀硝酸反应:Fe+![]() +4H+===Fe3++NO↑+2H2O
+4H+===Fe3++NO↑+2H2O
C.向明矾溶液中加入Ba(OH)2溶液至Al3+刚好沉淀完全:2Al3++3![]() +3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
D.碳酸钠水解:![]() +H2O
+H2O![]() +OH-
+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】难溶电解质在水中存在沉淀溶解平衡,如AgClAg++Cl-,上述平衡中存在两个过程:一方面是在水分子的作用下,溶液中少量的Ag+和Cl-脱离AgCl表面进入水中(溶解过程);另一方面,溶液中的Ag+和Cl-受AgCl表面阴、阳离子的吸引,回到AgCl表面析出(沉淀过程)。当溶解速率和沉淀速率相等时,形成AgCl饱和溶液,达到沉淀溶解平衡。用溶度积常数表示:Ksp=c(Ag+)c(Cl-)。当溶液中的c(Ag+)c(Cl-)>Ksp(AgCl)时,即有沉淀析出。
已知:在室温下,Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=1.8×10-10。
向BaCl2溶液中加入AgNO3和KBr,当两种沉淀刚好共存时,溶液中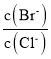 =____,写出简要计算过程:_________。
=____,写出简要计算过程:_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com